题目内容
观察下列几个装置示意图,有关叙述正确的是
| A.装置①中阳极上析出红色固体 |
| B.装置②的待镀铁制品应与电源负极相连 |
| C.装置③中外电路电子由b极流向a极 |
| D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
B
解析试题分析:A、装置①中阳极上发生电解质中的氯离子失电子生成氯气的反应,所以阳极上没有红色固体生成,错误;B、在电镀池中,镀件金属应该做阴极,镀层金属做阳极,所以待镀铁制品应与电源负极相连,正确;C、装置③闭合电键后,形成燃料电池,通氢气的极是负极,同氧气的极是正极,电子从负极流向正极,即由a极流向b极,错误;D、装置④中,离子交换膜只允许离子通过,不允许分子通过,错误。
考点:本题考查原电池和电解池的原理。

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
下图所示的装置中,M为活动性顺序位于氢之前的金属,N为石墨棒。下列关于此装置的叙述中,不正确的是( )
| A.N上有气体放出 |
| B.M为负极,N为正极 |
| C.化学能转变为电能的装置 |
| D.导线中有电流通过,电流方向由M到N |
在下图所示的原电池中,正极发生的反应是
A.2H++2e― H2↑ H2↑ | B.Cu–2e― Cu2+ Cu2+ |
C.Cu2++2e― Cu Cu | D.Zn–2e― Zn2+ Zn2+ |
下列关于下图所示原电池装置的叙述中,正确的是( ) 
| A.铜片作负极,质量逐渐减小 | B.溶液的pH逐渐减小 |
| C.电流从锌片经导线流向铜片 | D.氢离子在铜片表面被还原 |
把甲、乙、丙、丁四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若甲、乙相连,甲的质量减少;丙、丁相连,丁上有气泡逸出;甲、丙相连,甲上发生氧化反应;乙、丁相连,乙是电子流入的一极。则四种金属的活泼性顺序由大到小排列为
| A.甲>乙>丙>丁 | B.甲>丙>乙>丁 |
| C.甲>丙>丁>乙 | D.乙>丁>丙>甲 |
按下图所示装置进行有关实验,则下列叙述正确的是
| A.甲装置用作原电池时,锌为正极 |
| B.甲装置用作原电池时,银棒上发生:Ag+ +e-= Ag |
| C.乙装置用作铜片镀镍时,镍作阴极 |
| D.实现铜片表面镀镍时,可将甲中锌棒与乙中铜片相连,甲中银棒与乙中镍片相连 |
在下图所示的原电池中,下列说法错误的是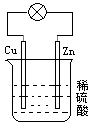
| A.溶液的pH逐渐变小 | B.负极附近SO42-离子浓度逐渐增大 |
| C.正极有H2逸出 | D.正极质量无变化 |
某研究性学习小组进行电化学实验,研究装置如图所示。
有关说法不正确的是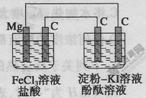
| A.镁为负极 |
| B.原电池中碳极的电极反应式为Fe3++e-=Fe2+ |
| C.电解池中阳极处先变红 |
| D.电解池中阴极的电极反应式为2H++2e-=H2↑ |