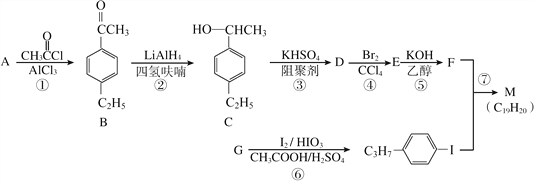
题目内容
【题目】NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:Na2CO3+nH2O=Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管已部分变质的一定质量的NaHCO3样品溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(不计溶于水的CO2气体)

试求:
(1)该盐酸溶液的物质的量浓度为_______mol·L-1。
(2)未变质前NaHCO3的物质的量为 ________mol。
【答案】 2 mol·L-1 0.22 mol
【解析】试题分析 (1)根据碳酸钠与盐酸反应的过程是![]() ,开始产生气体时的反应为
,开始产生气体时的反应为![]() ,根据表格数据可知,加入5mL盐酸放出224mL气体计算盐酸的浓度; (2)根据钠元素守恒计算NaHCO3的物质的量。
,根据表格数据可知,加入5mL盐酸放出224mL气体计算盐酸的浓度; (2)根据钠元素守恒计算NaHCO3的物质的量。
解析: (2)设盐酸的浓度为c mol·L-1,

![]() ,c=2 mol·L-1;
,c=2 mol·L-1;
(2) 根据表格数据,溶液中n(CO32-)+n(HCO3-)=![]() 0.2mol,
0.2mol,
用于将CO32-转变为HCO3-消耗HCl的体积为10mL,物质的量为10×10-3L×2.0mol/L=0.02mol;故n(Na2CO3)=0.02mol 、n(NaHCO3)=0.2mol-0.02mol=0.18mol,则钠元素的物质的量为0.18mol+0.02mol×2=0.22mol,根据钠元素守恒计算NaHCO3的物质的量为0.22mol。
解析:碳酸钠与盐酸的反应分2步进行,先生成碳酸氢钠,后碳酸氢钠与盐酸反应生成二氧化碳气体。

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目