题目内容
下列叙述正确的是 ( )
| A、0.1mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C、pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)不相等 |
| D、在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性;
B.水的离子积常数只与温度有关;
C.c(H+)=10-pH;
D.2AgCl+Na2S=Ag2S+2NaCl.
B.水的离子积常数只与温度有关;
C.c(H+)=10-pH;
D.2AgCl+Na2S=Ag2S+2NaCl.
解答:
解:A.醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,则c(H+)<c(OH-),故A错误;
B.水的离子积常数只与温度有关,温度不变水的离子积常数不变,故B错误;
C.c(H+)=10-pH,两种溶液的pH相等,所以氢离子浓度相等,故C错误;
D.发生2AgCl+Na2S=Ag2S+2NaCl,所以溶液中c(S2-)下降,故D正确;
故选D.
B.水的离子积常数只与温度有关,温度不变水的离子积常数不变,故B错误;
C.c(H+)=10-pH,两种溶液的pH相等,所以氢离子浓度相等,故C错误;
D.发生2AgCl+Na2S=Ag2S+2NaCl,所以溶液中c(S2-)下降,故D正确;
故选D.
点评:本题考查了离子浓度大小比较,根据物质之间的反应、盐类水解等知识点分析解答,注意水的离子积常数只与温度有关,与溶液酸碱性、溶液浓度无关,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列两种气体的体积一定相等的是( )
| A、质量相等,密度相等的Cl2和NH3 |
| B、同温同质量的CO和C2H4 |
| C、同温同压下同质量的CO2和SO2 |
| D、同压同质量的C3H6和CO2 |
下列说法正确的是( )
| A、汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 |
| B、豆科作物根瘤菌将含氮化合物转化为蛋白质是氮的固定 |
| C、SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆 |
| D、乙醇、乙烯、乙醛都能使酸性高锰酸钾溶液褪色 |
反应2NO2(g)?2NO(g)+O2(g);△H>0,密闭容器中进行,并达到平衡.要使体系中气体颜色加深,正反应速率降低,应采用的措施是( )
| A、加压 | B、减压 |
| C、降温 | D、充入氧气 |
下列叙述正确的是( )
| A、离子晶体中可能含有非极性共价键 |
| B、原子晶体中的相邻原子间只存在非极性共价键 |
| C、分子晶体中一定含有共价键 |
| D、共价化合物中可能含有离子键 |
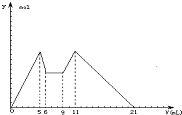 如图是向MgCl2和AlCl3混合液中,先加入NaOH溶液后又滴加盐酸,所得沉淀y(mol)与试剂体积V(mL)之间的关系.以下结论错误的是( )
如图是向MgCl2和AlCl3混合液中,先加入NaOH溶液后又滴加盐酸,所得沉淀y(mol)与试剂体积V(mL)之间的关系.以下结论错误的是( )| A、c(NaOH):c(HCl)=2:1 |
| B、原混合液中c(Al3+):c(Mg2+):c(Cl-)=1:1:5(不考虑离子的水解) |
| C、NaOH和盐酸的分界点是6mL处 |
| D、从7到9,都发生离子反应H++OH-→H2O |
有NaCl和MgCl2组成的混合物153.5g,溶于水配成1L溶液,此溶液中Cl-的物质的量浓度为3mol/L,则原混合物中的MgCl2的质量为( )
| A、95g | B、47.5g |
| C、58.5g | D、117g |
如图所示,△H1=-393.5kJ?mol-1,△H2=-395.4kJ?mol-1,下列说法正确的是( )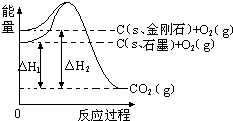

| A、1mol石墨的总键能比1mol金刚石的总键能小1.9kJ |
| B、石墨和金刚石的转化是物理变化 |
| C、金刚石的稳定性强于石墨 |
| D、C(s、石墨)═C(s、金刚石)△H=+1.9kJ?mol-1 |
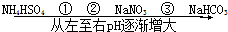 在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示.图中①、②、③可能是( )
在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示.图中①、②、③可能是( )| A、NH4NO3、(NH4)2SO4、CH3COONa |
| B、(NH4)2SO4、NH4Cl、C6H5ONa |
| C、(NH4)2SO4、NH4NO3、Na2CO3 |
| D、(NH4)2SO4、NH4NO3、CH3COONa |