题目内容
有NaCl和MgCl2组成的混合物153.5g,溶于水配成1L溶液,此溶液中Cl-的物质的量浓度为3mol/L,则原混合物中的MgCl2的质量为( )
| A、95g | B、47.5g |
| C、58.5g | D、117g |
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:令NaCl和MgCl2的物质的量分别为x mol、y mol,根据二者质量与氯离子物质的量列方程计算x、y,再根据m=nM计算.
解答:
解:令NaCl和MgCl2的物质的量分别为x mol、y mol,根据二者质量与氯离子物质的量,则:
解得x=y=1
故原混合物中的MgCl2的质量为:1mol×95g/mol=95g,
故选A.
|
解得x=y=1
故原混合物中的MgCl2的质量为:1mol×95g/mol=95g,
故选A.
点评:本题考查混合物有关计算,明确溶液中氯离子来源于氯化钠、氯化镁是关键,比较基础.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
下列说法中正确的是( )
| A、乙烯中碳碳双键的键能是乙烷中碳碳单键的键能的2倍 |
| B、N-O键的极性比C-O键的极性大 |
| C、氮气分子中含有1个σ键和2个π键 |
| D、NH4+中4个N-H键的键能不相同 |
在一定条件下,下列转化不能通过一步反应实现的是( )
| A、HCl→NaCl |
| B、CO→CaCO3 |
| C、Fe→FeSO4 |
| D、Ca(OH)2→NaOH |
下列叙述正确的是 ( )
| A、0.1mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C、pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)不相等 |
| D、在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
有机物H 中不含有的官能团是( )
中不含有的官能团是( )
 中不含有的官能团是( )
中不含有的官能团是( )| A、醇羟基 | B、羧基 | C、醛基 | D、酯基 |
反应2A(气)?2B(气)+C(气);△Η>0,在未用催化剂的条件下已达到平衡,现要使正反应速率降低,[B]减小,应采用的措施( )
| A、升温 | B、增大反应器体积 |
| C、增大c(A) | D、降温 |
对于反应A2(g)+3B2(g)?2C(g);△H<0,则下列说法错误的是( )
| A、气体C的分子式为AB3 |
| B、使用催化剂能使平衡向生成C的方向移动,并放出更多的热量 |
C、A2,B2反应生成C,C的产率与温度.压强(P)关系的示意图如图: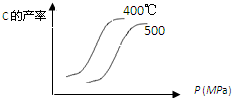 |
| D、恒温恒容时,若密闭容器内压强不变,表示反应已建立平衡 |
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O
6Cu+SO2↑,关于该反应的说法中正确的是( )
| ||
| A、该反应的氧化剂只有Cu2O |
| B、每生成19.2g Cu,反应中转移0.6mol电子 |
| C、Cu既是氧化产物又是还原产物 |
| D、Cu2S在反应中既是氧化剂,又是还原剂 |
已知NH4NO3受到撞击或受热时会发生爆炸性分解:2NH4NO3═4H2O↑+2N2↑+O2↑.在反应中,被还原的原子和被氧化的原子的物质的量之比是( )
| A、3:5 | B、1:1 |
| C、1:2 | D、2:1 |