题目内容
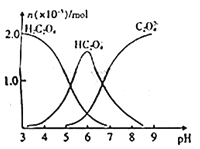
【题目】A、B、C、D、E 五种短周期元素(A、B、C、D、E 分别代表元素符号),它们的原子序数依次增大; A 是元素周期表中原子半径最小的元素;B 元素最高价氧化物对应的水化物与其氢化物反应生成一种盐 X;D 与 A 同主族,且与 E 同周期;E 元素原子的最外层电子数是其次外层电子数的 3/4 倍;C 与 E 同 主族。请回答下列问题:
(1)X 的化学式_____。
(2)下列各项中,能说明元素 C 比 E 非金属性强的事实有_____(填序号).
① 氢化物H2E的酸性比H2C强
② 氢化物H2C的热稳定性比H2E强
③ 氢化物H2E的水溶液放置在空气中会变浑浊
④ C 与 E 组成化合物,C 显负价
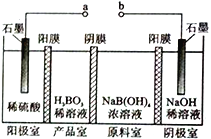
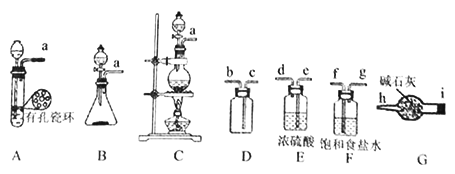
(3)将由 BC 和BC2组成的混合气体通入如图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。

已知(i)浓硝酸能将气体 BC 氧化成BC2,而稀硝酸不能氧化 BC。
(ii)NaOH 溶液与BC2反应的化学方程式为:2NaOH+2BC2═NaBC2+NaBC+H2O,NaOH溶液与 BC 气体不反应。 装置②、③中盛放的药品依次是_______、______________.
(4)通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是__________(填 一种气体的化学式)。
【答案】NH4NO3 ②③④ 稀HNO3 浓HNO3 CO2.
【解析】
A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A是元素周期表中原子半径最小的元素,则A为H元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X,则B为N元素,X为硝酸铵;D与A同主族,且与E同周期,所以D为Na,E为第三周期元素,E元素原子的最外层电子数是其次外层电子数的![]() 倍,则最外层电子数为6,即E为S元素;C与E同主族,则C为O元素。
倍,则最外层电子数为6,即E为S元素;C与E同主族,则C为O元素。
(1)由上述分析可知,X为NH4NO3,故答案为:NH4NO3;
(2)C为O,E为S,非金属性C>E,氢化物酸性强弱不能说明元素的非金属性强弱,气态氢化物的稳定性及单质之间的置换反应可以确定元素非金属性强弱,O与S组成化合物,O显负价,说明O元素吸引电子能力更强,非金属性更强,故②③④能说明氧元素非金属性更强,故答案为:②③④;
(3)BC为NO,BC2为NO2,浓硝酸能将气体NO氧化成BNO2,而稀硝酸不能氧化NO,NaOH溶液可以吸收NO2,不能与NO气体不反应,则①中为水,②中为稀硝酸,③中为浓硝酸可验证浓硝酸的氧化性比稀硝酸的氧化性强,生成的二氧化氮在⑤中与碱反应,故答案为:稀HNO3;浓HNO3;
(4)为避免NO被氧化,在实验之前应通入的气体排尽装置内的空气,该气体可以是CO2、N2、H2等,故答案为:CO2或N2或H2等。

 阅读快车系列答案
阅读快车系列答案【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:______。
(2)联氨(N2H4)是一种还原剂,能与氧气反应生成氮气和水蒸气。试结合下表数据,写出在该反应的热化学方程式:____________________________。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:__________________________。
(4)常温下用氨水吸收CO2可得利(NH4)2CO3溶液,在(NH4)2CO3溶液中,c(OH-)_________c(H+)(填“>”“<”或“=”);反应NH4++CO32-+H2O![]() NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]() N2O4其相关图像如下。
N2O4其相关图像如下。
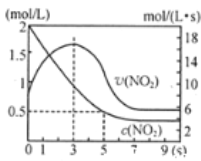
①0~3s时v(NO2)增大的原因是_________。
②5s时NO2转化率为__________。