��Ŀ����
����Ŀ����һ��������þ�������Ͷ��200 mL�����У�����ȫ���ܽ����������Һ�м���5 mol/L��NaOH��Һ�����ɳ��������ʵ���n�����NaOH��Һ�����V�ı仯��ͼ��ʾ��
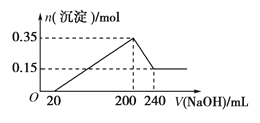
��1������NaOH 0�� 20mL ʱ������Ӧ���ӷ���ʽ___________________��
����NaOH 20�� 200mL ʱ������Ӧ���ӷ���ʽ___________________��
����NaOH 200�� 240mL ʱ������Ӧ���ӷ���ʽ___________________��
��2��þ������������Ϊ________g
��3����������ʵ���Ũ��Ϊ___________ mol/L
��4�����ɵ������ڱ�״���µ����Ϊ__________L
���𰸡�OH-+H+=H2O Mg2++2OH-=Mg(OH)2����Al3++3OH-=Al(OH)3�� Al(OH)3+ OH-=AlO2-+2H2O 9 2.5 10.08
��������
��1����ͼ���֪���ӿ�ʼ������NaOH��Һ20mL��û�г������ɣ�˵��ԭ��Һ�������ܽ�Mg��Al��������ʣ�࣬��ʱ�����ķ�ӦΪ��H2SO4+2NaOH=Na2SO4+2H2O�����ӷ���ʽΪOH-+H+=H2O������NaOH 20�� 200mL ʱ�����ɳ������ﵽ���ֵ��Mg2+��Al3+ǡ����ȫ���������ӷ���ʽMg2++2OH-=Mg(OH)2����Al3++3OH-=Al(OH)3������ͼ���֪����200mL��240mL��NaOH�ܽ�Al(OH)3��Al(OH)3+ OH-=AlO2-+2H2O��
��2����NaOH��Һ200mLʱ�����������ʱ����ΪMg(OH)2��Al(OH)3���������ʵ���֮��Ϊ0.35mol����NaOH��Һ240mLʱ���������ټ��٣���ʱȫ��ΪMg(OH)2�����ʵ���Ϊ0.15mol�����Գ��������Mg(OH)2Ϊ0.15mol��Al(OH)3Ϊ0.35mol-0.15mol=0.2mol����Ԫ���غ��֪n��Al��=n[Al(OH)3]=0.2mol��n��Mg��=n[Mg(OH)2]=0.15mol������þ������������Ϊ0.2mol��27g/mol+0.15mol��24g/mol=9g���ʴ�Ϊ��9��
��3�����������ʱΪMg(OH)2��Al(OH)3����Һ������ΪNa2SO4��������Ԫ���غ��֪��ʱn��Na2SO4������200mL����������Һ�к��е�n��NaOH����1/2��������n��Na2SO4��=1/2��0.2L��5mol/L=0.5mol�����������Ũ��Ϊ![]() =2.5mol/L���ʴ�Ϊ��2.5mol/L��
=2.5mol/L���ʴ�Ϊ��2.5mol/L��
��4���������Ϸ�����֪n��Al��=0.2mol��n��Mg��=0.15mol�����ݵ���ת���غ��֪2n��H2��=3n��Al��+2n��Mg��=3��0.2mol+2��0.15mol=0.9mol������n��H2��=0.45mol�����������Ϊ0.45mol��22.4mol/L=10.08L���ʴ𰸣�10.08L��

����Ŀ����Դ������CO������Ҫ���塣
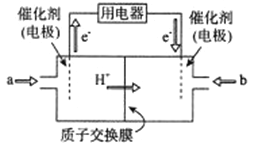
(1)CO����Ƴ�ȼ�ϵ�أ�����Li2CO3��Na2CO3�Ļ������Ϊȼ�ϵ�صĵ���ʣ��������Ǻ�CO2��O2������ʱ������ӦΪ__________________���Ը�ȼ�ϵ��Ϊ��Դ��������������������ɻ������ᣬͬʱ�Ƶø�����������װ����ͼ��ʾ(�缫��Ϊʯī�缫)����װ����Ӧѡ��_______(����������������)���ӽ���Ĥ��д�����ʱNO2������Ӧ�ĵ缫��Ӧʽ��___________________��

(2)CO�Ǹ�¯��������Ҫ��ԭ��������ʱ��������Ҫ��Ӧ�У�
��Ӧ | ��H(kJ/mol) |
I. Fe2O3(s)+3C(s) | +489 |
II. Fe2O3(s)+3CO(g) | -27 |
III. C(s)+CO2(g) | X |
�Լ��㣬�Լ��㣬X=_________��
T1��ʱ����ij�����ܱ������м���һ������Fe2O3��C��������ӦI����Ӧ�ﵽƽ�����t1ʱ�̸ı�ij������v(��)��ʱ��(t)�ı仯��ϵ��ͼ��ʾ����t1ʱ�̸ı������������_____________________��
a�������¶ȡ�������䣬ʹ�ô��� b������������䣬�����¶�
c�������¶Ȳ��䣬ѹ��������� d�������¶ȡ�������䣬����CO

(3)��һ���¶��£���ij����ɱ�ĺ�ѹ(P��)�ܱ������м���1mol CO2��������̼������ӦIII��ƽ��ʱ��ϵ����������������¶ȵĹ�ϵ��ͼ��ʾ��
��650��ʱ����Ӧ��ƽ���CO2��ת����Ϊ____________��
��T��ʱ���÷�Ӧ�ﵽƽ��ʱ����˵������ȷ����__________________��
a�������ܶȱ��ֲ���
b��2v��(CO2)=v��(CO)
c���������������������ٳ���������CO2��CO��ƽ�����淴Ӧ�����ƶ�
d���������������������ٳ���������壬v����v������С��ƽ�ⲻ�ƶ�
e���������������佫�������ѹ����һ�벢ά��������䣬�ٴδ�ƽ��ʱѹǿС��ԭƽ���2��
�۸���ͼ�����ݣ����㷴ӦIII��T��ʱ��ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��KP=___________(����ѹǿΪP�����ú�P���Ĵ���ʽ��ʾ)