题目内容
【题目】随着现代工业的发展,二氧化碳污染的处理成为科学研究的重点,回答下列问题:
I.有人提出利用H2还原CO2使其转化为有机化工的主要原料乙烯。
(1)查阅资料:H2的燃烧热为285.8kJ/mol,C2H4的燃烧热为l41lkJ/mol,lmolH2O(1)转化为H2O(g)需吸收44kJ的热量。则反应6H2(g)+2CO2(g) ![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
△H=___________kJ/mol。
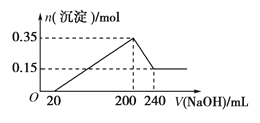
(2)下图是探究不同温度对CO2的转化率和催化剂的催化效率影响的示意图。

①生产中通常选用的温度最好是___________,理由是___________。
②图中表示的化学平衡常数:M___________N(填>、=、<)
③250℃时,在2L密闭容器中分别充入6molH2和2 molCO2,到达平衡时体系中C2H4的体积分数为___________。
Ⅱ.CO在一定条件下,能与H2合成二甲醚:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)。
CH3OCH3(g)+3H2O(g)。
(1)在1L的密闭容器中分别充入2.5molH2与 bmol CO2发生反应,在不同温度下达到平衡状态时测得实验数据如下表:

①到达平衡时若升高温度,则上述平衡___________方向移动(填“正反应”或“逆反应”)。
②转化率:x___________y(填>、=、<)
(2)新型高效的二甲醚燃料电池工作时总反应式:CH3OCH3+3O2=2CO2+3H2O。
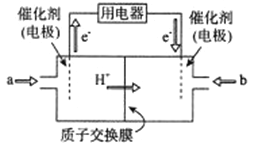
①该电池的负极是___________(填a或b),负极电极反应式为___________;
②利用该电池冶铝,若制得金属铝54g理论上消耗二甲醚___________g。
【答案】-127.8 250℃ 此时催化剂活性最高 > 7.7%或1/13 逆反应 > a CH3OCH3+3H2O-12e-=2CO2↑+12H+ 23
【解析】
I.(1)根据燃烧热的概念和题意写出热化学方程式:H2(g)+0.5O2(g)=H2O(1)△H=-285.8kJ/mol①;C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ·mol-1②;H2O(g)=H2O(l)△H=-44kJ·mol-1③;利用盖斯定律将①×6-②-③×4可得。
(2)①根据图示催化剂的反应活性和温度对速率、平衡的影响综合考虑:此时催化剂活性最高。
②升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M点化学平衡常数大于N点;
③根据三段式计算;
Ⅱ.(1)①分析表格数据,根据温度对CO2的转化率影响分析;
②由CO2起始物质的量为1.25mol时,温度越高,CO2的转化率越小,说明正反应是放热反应,故结合表格分析。
(2)①根据电子流动方向和氢离子移动方向可知,通入a的电极为负极;电极反应为:CH3OCH3+3H2O-12e-=2CO2↑+12H+
②根据关系式4Al~12e-~CH3OCH3计算。
(1)根据H2(g)的燃烧热为285.8kJ·mol-1,则其热化学方程式为:H2(g)+0.5O2(g)=H2O(1)△H=-285.8kJ/mol①;CH2=CH2(g)的燃烧热为1411.0kJ·mol-1,其热化学方程式为:C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ·mol-1②;H2O(g)=H2O(l)△H=-44kJ·mol-1③;利用盖斯定律将①×6-②-③×4可得:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)△H=-127.8kJ·mol-1。
CH2=CH2(g)+4H2O(g)△H=-127.8kJ·mol-1。
(2)①如图所示,化学反应速率随温度的升高而加快,催化剂的催化效率随温度升高先增大后降低,所以根据催化剂的反应活性和温度对速率、平衡的综合影响角度,最好选择250℃;
②升高温度二氧化碳的平衡转化率减小,则升温平衡逆向移动,所以M点化学平衡常数大于N点;
③在2L密闭容器中分别充入6 mol H2和2 mol CO2,由图可知250℃时,M点的二氧化碳转化率50%,由方程式可得
6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)
CH2=CH2(g)+4H2O(g)
起始量(mol·L-1) 3 1 0 0
变化量(mol·L-1) 1.5 0.5 0.25 1
平衡量(mol·L-1) 1.5 0.5 0.25 1
产物CH2=CH2的体积分数=![]() =7.7%
=7.7%
Ⅱ.(1)①分析表格可知,当CO2起始物质的量为1.25mol时,温度越低,CO2的转化率越大,说明降低温度平衡向正反应方向移动,故升高温度平衡向逆反应方向移动;
②由CO2起始物质的量为1.25mol时,温度越高,CO2的转化率越小,说明正反应是放热反应,故结合表格可知w<32,x>33;由于CO2(g)、H2(g)按物质的量1:3反应,H2(g)物质的量为2.5mol,CO2的物质的量(b)越大,CO2的转化率越小,则y<w,综合上述分析可知x>33>32>w>y;
(2)①根据图知交换膜是质子交换膜,则电解质溶液呈酸性,根据电子流动方向和氢离子移动方向可知,通入a的电极为负极、通入b的电极为正极,负极上二甲醚失去电子发生氧化反应生成二氧化碳,负极反应式为 CH3OCH3+3H2O-12e-=2CO2↑+12H+;根据电子守恒,可以建立关系式4Al~12e-~CH3OCH3,由此可得若制得金属铝54g,理论上消耗甲醇23g。