题目内容
【题目】铁元素的化合价有+2和+3价,某兴趣小组利用含铁的盐溶液进行化学实验:
(1)取一定量氯化亚铁固体,配制成0.1mol/L 的溶液,在FeCl2溶液中需加入少量铁屑,其目的是_______________。
(2)在氯化铁溶液中滴入1滴KSCN溶液,溶液变________色,接着在变色的溶液中滴入2 mL 0.5mol/L AgNO3溶液,产生白色沉淀(已知:AgSCN为白色沉淀) ,溶液逐渐恢复到原来颜色,这种变化是因为________________________________________(请从平衡移动的角度解释)。
用下图装置进行SO2性质的研究。

(3)用______取25.00mL FeCl3和Ba(NO3)2的混合溶液,通入SO2气体一段时间后,发现A中产生白色沉淀,该白色沉淀的化学式是______,推测产生白色沉淀的原因可能是_____________
(4)工业石灰石-石膏湿法烟气脱硫工艺技术的原理是:烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4·2H2O)。某电厂用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则理论上可得到_________吨石膏。
【答案】防止亚铁离子被氧化 血红 溶液中发生Fe3++3SCN-![]() Fe(SCN)3使局部变红, Ag+与SCN-反应生成AgSCN沉淀,降低了c(SCN-),平衡逆向移动,血红色逐渐褪去 酸式滴定管 BaSO4 Fe3+将SO2氧化成SO42-,再与Ba2+结合生成BaSO4白色沉淀或酸性条件下NO3-将SO2氧化成SO42-,再与Ba2+结合生成BaSO4白色沉淀 38.7
Fe(SCN)3使局部变红, Ag+与SCN-反应生成AgSCN沉淀,降低了c(SCN-),平衡逆向移动,血红色逐渐褪去 酸式滴定管 BaSO4 Fe3+将SO2氧化成SO42-,再与Ba2+结合生成BaSO4白色沉淀或酸性条件下NO3-将SO2氧化成SO42-,再与Ba2+结合生成BaSO4白色沉淀 38.7
【解析】
(1)铁和氯化铁反应生成氯化亚铁,氯化亚铁溶液中加入铁粉防止氯化亚铁被氧化;
(2)Fe3+遇KSCN溶液显血红色;在氯化铁溶液中滴入1滴KSCN溶液,发生Fe3++3SCN-![]() Fe(SCN)3,滴加AgNO3溶液,Ag+与SCN-反应生成AgSCN沉淀,降低了c(SCN-),平衡逆向移动;(3)二氧化硫具有还原性,酸性条件下,能被硝酸根离子或铁离子氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀;(4)二氧化硫与碳酸钙反应生成亚硫酸钙与二氧化碳,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO42H2O;根据关系式S~SO2~CaSO42H2O来计算。
Fe(SCN)3,滴加AgNO3溶液,Ag+与SCN-反应生成AgSCN沉淀,降低了c(SCN-),平衡逆向移动;(3)二氧化硫具有还原性,酸性条件下,能被硝酸根离子或铁离子氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀;(4)二氧化硫与碳酸钙反应生成亚硫酸钙与二氧化碳,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO42H2O;根据关系式S~SO2~CaSO42H2O来计算。
(1)铁和氯化铁反应生成氯化亚铁,在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化;(2)Fe3+遇KSCN溶液显血红色,则在氯化铁溶液中滴入1滴KSCN溶液,发生Fe3++3SCN-![]() Fe(SCN)3,使溶液变血红色;滴加AgNO3溶液,Ag+与SCN-反应生成AgSCN沉淀,降低了c(SCN-),平衡逆向移动,血红色逐渐褪去;(3) FeCl3和Ba(NO3)2的混合溶液呈酸性,且有较强氧化性,则量取25.00mL FeCl3和Ba(NO3)2的混合溶液,应选用酸式滴定管;向混合溶液中通入SO2,因二氧化硫具有还原性,酸性条件下,能被硝酸根离子或铁离子氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀;(4)二氧化硫与碳酸钙反应生成亚硫酸钙与二氧化碳,反应方程式为:SO2+CaCO3═CaSO3+CO2,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO42H2O,反应方程式为:2CaSO3+O2+4H2O═2[CaSO42H2O],总反应为:2CaCO3+2SO2+O2+4H2O═2[CaSO42H2O]+2CO2;
Fe(SCN)3,使溶液变血红色;滴加AgNO3溶液,Ag+与SCN-反应生成AgSCN沉淀,降低了c(SCN-),平衡逆向移动,血红色逐渐褪去;(3) FeCl3和Ba(NO3)2的混合溶液呈酸性,且有较强氧化性,则量取25.00mL FeCl3和Ba(NO3)2的混合溶液,应选用酸式滴定管;向混合溶液中通入SO2,因二氧化硫具有还原性,酸性条件下,能被硝酸根离子或铁离子氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀;(4)二氧化硫与碳酸钙反应生成亚硫酸钙与二氧化碳,反应方程式为:SO2+CaCO3═CaSO3+CO2,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO42H2O,反应方程式为:2CaSO3+O2+4H2O═2[CaSO42H2O],总反应为:2CaCO3+2SO2+O2+4H2O═2[CaSO42H2O]+2CO2;
S~SO2 ~CaSO42H2O
32 172
300t×2.5%×96% m
![]() =
=![]() ,解得m=38.7t。
,解得m=38.7t。

 阅读快车系列答案
阅读快车系列答案【题目】中国科学家用金属钠和CO2在一定条件下制得了金刚石:4 Na + 3CO2![]() 2 Na2CO3 + C(金刚石),以下是一些物质的熔沸点数据(常压):
2 Na2CO3 + C(金刚石),以下是一些物质的熔沸点数据(常压):
钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
(1)若反应在常压、890℃下进行,写出该反应的平衡常数表达式_____________________,若3v正(Na)=4v逆(CO2),则_____(选填序号)。
a.反应肯定达到平衡 b.反应可能达到平衡 c.反应肯定未达平衡
(2)若反应在10L密闭容器、常压下进行,5min内,测得金刚石的质量增加了6 g,该时间段内v(CO2)=______________,若反应温度由890℃升高到1860℃,则容器内气体的平均相对分子质量将________(选填“增大”、“减小”或“不变”) 。
(3)反应中还有石墨生成,已知:C(石墨)![]() C(金刚石),若升高温度,生成的碳单质中,金刚石的含量将增大,则该反应的正反应是_________反应(填“吸热”或“放热”)。
C(金刚石),若升高温度,生成的碳单质中,金刚石的含量将增大,则该反应的正反应是_________反应(填“吸热”或“放热”)。
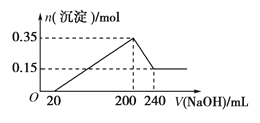
(4)碳酸钠溶液中滴入盐酸的反应过程如右图所示,反应至A点时,未产生二氧化碳,请用离子方程式解释原因:_________________,继续滴加盐酸,反应至B点,B点溶液中溶质的化学式是__________。