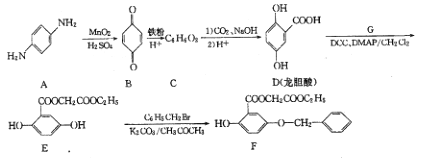
题目内容
【题目】己知: Fe3O4能与高浓度盐酸反应,与低浓度盐酸不反应。某研究性学习小组通过实验探究,欲确定某地所产青砖中是否含有FeO、Fe3O4和Fe2O3, 并测定青砖中铁元素的质量分数。回答下列问题:
(一)实验准备
(l)本实验探究部分需在无氧环境下进行,故配制溶液的蒸馏水常用_____法除去溶解氧。该实验所用试管中均需充满CO2,请选用下列装置制取干燥纯净的CO2气体,连接顺序为:
a![]() _____
_____![]() h、i(后续装置略去)。
h、i(后续装置略去)。

(二)探究青砖中是否含有Fe3O4和Fe2O3
组别 步骤及现象 | 第一组 | 第二组 | 第三组 |
步骤一 | 取试管l 、2 、3①分别加入2g青砖细粉②分别通入CO2气体至充满,用户塞子塞紧 | ||
步骤二 | 向试管1中注入10mL 3 mol/L盐酸,充分振荡 | 向试管2中注入10mL 6 mol/L盐酸,充分振荡 | 向试管3中注入10mL 12 mol/L盐酸,充分振荡 |
步骤三 | 取试管1、2、3中的上层清液各1mL于另三支试管中,再分别注入0.2mL相同浓度的KSCN溶液,振荡 | ||
步骤三的实验现象 | 溶液变红 且第一、二两组溶液颜色深浅相同 | 溶液变红 且较第一、二两组颜色更深 | |
(2)步骤二中,若不取下试管上的塞子,又不因盐酸加入导致试管内压强增大,使用注射器实现上述目的的操作方法为__________。
(3)Fe3O4与高浓度盐酸反应的离子方程式为________。
(4)用离子方程式表示溶液变红的原因__________。
(5)根据上述现象,可初步得出该青砖样品中所含铁的氧化物为________(填化学式)
(三)探究青砖中是否含有FeO
(6)另取一支充满CO2气体的试管,注入1mL上述试管1的上层清液和数滴K3[Fe(CN)6]溶液,若实验现象为_______,说明青砖中含有FeO。
(四)青砖样品中铁元素质量分数的测定
称取m1g 青砖细粉,用足量12mol/L盐酸充分溶解、过滤、洗涤(第一次)。将滤液(包括洗涤滤渣后的溶液)依次与足量的新制氯水、氢氧化钠溶液充分反应,过滤、洗涤(第二次),将沉淀灼烧至恒重,冷却后称得残留固体质量为m2g。
(7)若青砖中其它成分对实验无影响,则测得铁元素的质量分数为____(填含m1、m2的表达式);该实验若未进行第一次洗涤,则测得铁元素的质量分数______(填“偏高”、“偏低”或“无影响”)。
【答案】 煮沸 d、e![]() b、c 用两支注射器刺穿塞子插入试管中,其中一支抽出10mL气体,同时另一支注入10mL盐酸 Fe3O4+8H+=Fe2++2Fe3++4H2O Fe3++3SCN-=Fe(SCN)3 Fe2O3、Fe3O4 生成蓝色沉淀 7m2/(10m1)×100% 偏低
b、c 用两支注射器刺穿塞子插入试管中,其中一支抽出10mL气体,同时另一支注入10mL盐酸 Fe3O4+8H+=Fe2++2Fe3++4H2O Fe3++3SCN-=Fe(SCN)3 Fe2O3、Fe3O4 生成蓝色沉淀 7m2/(10m1)×100% 偏低
【解析】(l)蒸馏水中含有溶解氧,而本实验需在无氧环境下进行,则需要将蒸馏水煮沸;用盐酸和碳酸钙制取CO2中混有HCl和水汽,需要用饱和碳酸氢钠溶液除去HCl、用浓硫酸干燥,根据气流方向,装置的连接顺序为a![]() d、e
d、e![]() b、c
b、c ![]() h、i;
h、i;
(2)步骤二中,用注射器添加盐酸的操作方法是用两支注射器刺穿塞子插入试管中,其中一支抽出10mL气体,同时另一支注入10mL盐酸;
(3) Fe3O4与高浓度盐酸反应生成氯化铁和氯化亚铁,根据电荷守恒和原子守恒,此反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O;
(4)在含有Fe3+的溶液中滴加KSCN溶液,溶液变红色,是因为 Fe3++3SCN-=Fe(SCN)3;
(5)上述实验中浓盐酸和稀盐酸溶解后的溶液中均含有Fe3+,即说明该青砖样品中所含铁的氧化物有 Fe2O3、Fe3O4;
(6)若溶液中滴加K3[Fe(CN)6]溶液会出现生成蓝色沉淀,说明溶液中含有Fe2+,即青砖中含有FeO;
(7)残留固体为Fe2O3,质量为m2g,则物质的量为![]() =
=![]() mol,,则测得铁元素的质量分数为
mol,,则测得铁元素的质量分数为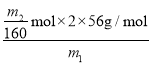 ×100%=
×100%=![]() ×100%;若第一次不洗涤,则浅渣表面附着的Fe2+、Fe3+未全部转移到溶液中,最终测定结果偏低。
×100%;若第一次不洗涤,则浅渣表面附着的Fe2+、Fe3+未全部转移到溶液中,最终测定结果偏低。