题目内容
【题目】某研究小组利用海水提取粗盐后得到的苦卤(含Mg2+、Ca2+、Br-等离子的溶液)提取Br2并制备含镁化合物。部分工艺流程设计如下:

回答下列问题:
(1)步骤I中用硫酸酸化可抑制氯气与水的反应,原因是____(结合离子方程式回答)。
(2)工业上常用Na2CO3法或SO2法实现含Br2混合气到液溴的转化,流程如下:
Na2CO3法:
![]()
SO2法:
![]()
① Na2CO3法中步骤Ⅲ的反应有气体生成,离子方程式为______。步骤V中蒸馏时蒸气出口温度通常控制在65-75℃,若温度过低,溴蒸出不充分;若温度过高,则会导致液溴中混有较多的____________。
② SO2法对比Na2CO3法的缺点是__________(答出一条即可)。
(3)提溴后所得含Mg2+、Ca2+的溶液可设计如下流程制各碱式碳酸镁[Mg5(OH)2(CO3)4·4H2O]和无水氯化镁:

① 步骤Ⅷ的化学方程式为_________。
② 若步骤X中生成的CO与CO2物质的量之比为3:1,写出反应的化学方程式__________。
③25℃,步骤Ⅵ生成Mg(OH)2沉淀后,若溶液中残留的Mg2+浓度为l.8×10-6mol/L 。则溶液的pH为________;此pH下,欲使Mg(OH)2沉淀中不含Ca(OH)2,则溶液中c(Ca2+)不能大于____(已知:25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Ca(OH)2]=5.5×10-6)
【答案】 溶液c(H+)增大,Cl2+H2O![]() H++Cl-+HClO的平衡逆移,从而抑制氯气与水的反应 3CO32-+3Br2=5Br-+BrO3-+3CO2↑ 水 SO2和Cl2有毒,可能导致环境污染 5Mg(HCO3)2
H++Cl-+HClO的平衡逆移,从而抑制氯气与水的反应 3CO32-+3Br2=5Br-+BrO3-+3CO2↑ 水 SO2和Cl2有毒,可能导致环境污染 5Mg(HCO3)2![]() Mg5(OH)2(CO3)4·4H2O↓+6CO2↑ 5MgO+5Cl2+4C
Mg5(OH)2(CO3)4·4H2O↓+6CO2↑ 5MgO+5Cl2+4C![]() 5MgCl2+3CO+CO2 11.5 0.55mol/L
5MgCl2+3CO+CO2 11.5 0.55mol/L
【解析】(1)因Cl2+H2O![]() H++Cl-+HClO,当溶液c(H+)增大,平衡逆移,从而抑制氯气与水的反应,故步骤I中用硫酸酸化时大致抑制氯气与水的反应的目的;
H++Cl-+HClO,当溶液c(H+)增大,平衡逆移,从而抑制氯气与水的反应,故步骤I中用硫酸酸化时大致抑制氯气与水的反应的目的;
(2)①用Na2CO3溶液吸收含Br2的混合气体,生成Br-、BrO3-的同时,反应有CO2气体生成,根据电子守恒、电荷守恒及原子守恒得此反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑;溴易挥发,含溴的水溶液中通蒸气可促进溴蒸发,但温度过高,水也易蒸发出,导致液溴中仍混有一定量的水;
②对比Na2CO3法 ,SO2法使用的SO2和Cl2有毒,可能导致环境污染;
(3)① 步骤Ⅷ将Mg(HCO3)2溶液加热得到碱式碳酸镁[Mg5(OH)2(CO3)4·4H2O],结合原子守恒,发生反应的化学方程式为5Mg(HCO3)2![]() Mg5(OH)2(CO3)4·4H2O↓+6CO2↑;
Mg5(OH)2(CO3)4·4H2O↓+6CO2↑;
② 步骤X高温加热MgO、Cl2及C的混合物,生成的CO与CO2物质的量之比为3:1,同时得到MgCl2,反应中氯气是氧化剂,碳是还原剂,根据电子守恒及原子守恒可得此反应的化学方程式5MgO+5Cl2+4C![]() 5MgCl2+3CO+CO2 ;
5MgCl2+3CO+CO2 ;
③已知:25℃时,Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=1.8×10-11,则c(OH-)=![]() mol/L=1×10-2.5mol/L,此时溶液的pH为14-2.5=11.5;Ksp[Ca(OH)2]=c(Ca2+)×c2(OH-)=5.5×10-6,c(Ca2+)=
mol/L=1×10-2.5mol/L,此时溶液的pH为14-2.5=11.5;Ksp[Ca(OH)2]=c(Ca2+)×c2(OH-)=5.5×10-6,c(Ca2+)= ![]() = 0.55mol/L。
= 0.55mol/L。

【题目】己知: Fe3O4能与高浓度盐酸反应,与低浓度盐酸不反应。某研究性学习小组通过实验探究,欲确定某地所产青砖中是否含有FeO、Fe3O4和Fe2O3, 并测定青砖中铁元素的质量分数。回答下列问题:
(一)实验准备
(l)本实验探究部分需在无氧环境下进行,故配制溶液的蒸馏水常用_____法除去溶解氧。该实验所用试管中均需充满CO2,请选用下列装置制取干燥纯净的CO2气体,连接顺序为:
a![]() _____
_____![]() h、i(后续装置略去)。
h、i(后续装置略去)。

(二)探究青砖中是否含有Fe3O4和Fe2O3
组别 步骤及现象 | 第一组 | 第二组 | 第三组 |
步骤一 | 取试管l 、2 、3①分别加入2g青砖细粉②分别通入CO2气体至充满,用户塞子塞紧 | ||
步骤二 | 向试管1中注入10mL 3 mol/L盐酸,充分振荡 | 向试管2中注入10mL 6 mol/L盐酸,充分振荡 | 向试管3中注入10mL 12 mol/L盐酸,充分振荡 |
步骤三 | 取试管1、2、3中的上层清液各1mL于另三支试管中,再分别注入0.2mL相同浓度的KSCN溶液,振荡 | ||
步骤三的实验现象 | 溶液变红 且第一、二两组溶液颜色深浅相同 | 溶液变红 且较第一、二两组颜色更深 | |
(2)步骤二中,若不取下试管上的塞子,又不因盐酸加入导致试管内压强增大,使用注射器实现上述目的的操作方法为__________。
(3)Fe3O4与高浓度盐酸反应的离子方程式为________。
(4)用离子方程式表示溶液变红的原因__________。
(5)根据上述现象,可初步得出该青砖样品中所含铁的氧化物为________(填化学式)
(三)探究青砖中是否含有FeO
(6)另取一支充满CO2气体的试管,注入1mL上述试管1的上层清液和数滴K3[Fe(CN)6]溶液,若实验现象为_______,说明青砖中含有FeO。
(四)青砖样品中铁元素质量分数的测定
称取m1g 青砖细粉,用足量12mol/L盐酸充分溶解、过滤、洗涤(第一次)。将滤液(包括洗涤滤渣后的溶液)依次与足量的新制氯水、氢氧化钠溶液充分反应,过滤、洗涤(第二次),将沉淀灼烧至恒重,冷却后称得残留固体质量为m2g。
(7)若青砖中其它成分对实验无影响,则测得铁元素的质量分数为____(填含m1、m2的表达式);该实验若未进行第一次洗涤,则测得铁元素的质量分数______(填“偏高”、“偏低”或“无影响”)。
【题目】在花瓶中插上一束美丽的鲜花,将会给你紧张而又忙碌的学习、生活带来轻松和愉悦的心情。可是过不了几天,花儿就会枯萎。如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成 分 | 质 量(g) | 摩尔质量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是_________(填字母)。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中的K+的物质的量浓度约为_________(阿司匹林中不含K+)。
(3)配制上述1L“鲜花保鲜剂”所需的仪器有:量筒、烧杯、玻璃棒、托盘天平、药匙、___________________。(填所缺仪器的名称)。
(4)在溶液配制过程中,下列操作对配制结果没有影响的是______(填字母)。
A.定容用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)实验室用固体加热制氨气的化学反应方程式为:___________________________。
(6)若将收集到的氨气溶于水配成100 mL的溶液,所得氨水中NH3物质量浓度(不考虑NH3与H2O的反应)为0.3 mol·L-1,则需要氨气的体积为________mL(标准状况)。
【题目】Ⅰ (1)下列实验操作或叙述正确的是_________(填字母)
A.向饱和苯酚钠溶液中,不断通入足量二氧化碳气体,溶液最终呈浑浊
B.用金属钠检验无水乙醇中含有的少量水
C.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯
D.向苯酚浓溶液中滴入少量浓溴水可观察到白色的三溴苯酚沉淀
E.只用水就能鉴别苯、硝基苯、乙醇
F.将10滴溴乙烷加入1mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子
G.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验
H.甲醛与苯酚制取酚醛树脂的反应属于缩聚反应
I.在蔗糖的水解液中加新制Cu(OH)2悬浊液,有砖红色沉淀生成
Ⅱ. 1—乙氧基萘常用作香料,也可合成其他香料。实验室制备1—乙氧基萘的过程如下:
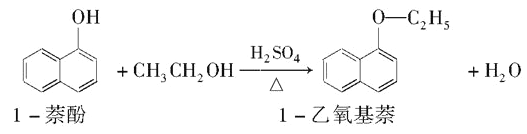
已知:1—苯酚的性质与苯酚相似,有难闻的苯酚气味。相关物质的物理常数如下:
物质 | 相对分子质量 | 状态 | 熔点 (℃) | 沸点 (℃) | 溶解度 | |
水 | 乙醇 | |||||
1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |
(1) 将72g1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应(加热装置和其它加持装置未画出)。实验中使用过量乙醇的原因是____________________。

(2)装置a的作用是________________。
(3)反应结束,将三颈烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;
A.③②④① B.①②③④ C.②①③④
(4)蒸馏时应该选择_________(选填编号),操作中应控制的关键实验条件为________________。

(5)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高,1-乙氧基萘的产量下降的原因是____________________。

(6)用金属钠可检验1—乙氧基萘是否纯净,简述实验现象与结论:_______________。
(7)提纯的产品经测定为73.1g,本实验中1—乙氧基萘的产率为________________。