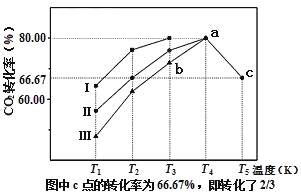
题目内容
【题目】羰基铁[Fe(CO)5]广泛用于催化剂,汽油抗爆剂,电子工业高频线圈制造。请回答下列问题:
(1)羰基铁[Fe(CO)5]中,碳、氧电负性大小比较____(用元素符号表示)。写出基态O的轨道表示式____;
(2)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子中C原子的杂化类型为____杂化。
(3)1molFe(CO)5分子中含σ键数目为____;CO配体中的配位原子是____。
(4)科学家通过X射线探明,FeO、MgO、CaO的晶体结构与NaCl晶体结构相似,比较晶体熔点的高低MgO____CaO(填“高于”或“低于”)
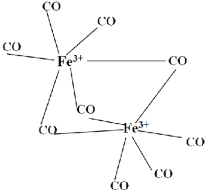
(5)羰基铁[Fe(CO)5]中铁为0价。如图中的羰基铁为+3价,此羰基铁的晶体类型为____;此羰基铁中每个铁的配位数是____。
【答案】O>C 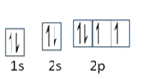 sp 10NA C 高于 分子晶体 3
sp 10NA C 高于 分子晶体 3
【解析】
(1)同周期元素电负性从左到右依次增大,故电负性O>C;基态O的电子排布式为1s22s22p4,它的轨道表示式为 ;
;
(2)根据题意可以推测出CO分子中有一条配位键,孤电子对数为1,σ键数为1,价层电子对数为2(结构式为![]() ,与三键相似),故C原子为sp杂化;
,与三键相似),故C原子为sp杂化;
(3)Fe(CO)5分子中CO与Fe之间的配位键是σ键,每个CO中有1个配位键也是σ键,故每个Fe(CO)5分子共有10个σ键,1molFe(CO)5分子中含σ键数目为10NA;由题意可知,CO分子中C原子上有一对孤对电子,所以CO中的C与Fe形成配位键;
(4)MgO和CaO都是离子晶体,熔沸点由晶格能决定,离子所带电荷数越多,离子半径越小,晶格能越大,熔沸点越高。Mg2+半径小于Ca2+半径,故MgO熔点高于CaO;
(5)由图可知,该羰基铁(III)可以看做是2个五羰基铁[Fe(CO)5]的二聚物,五羰基铁[Fe(CO)5]是分子晶体,故该化合物为分子晶体;该羰基铁(III)的形成过程是2个五羰基铁聚合,生成该羰基铁(III)和一个CO,中间的3个CO中的C与Fe成键,使Fe呈+3价,不属于配位键,故每个Fe的配位键只有3个;

【题目】氮化硅是一种高温陶瓷材料,它硬度大、熔点高,化学性质稳定,工业上普遍采用高纯硅与纯氮在1 300 ℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是________。(填序号)
A.制汽轮机 | B.制有色玻璃 |
C.制永久性模具 | D.制造柴油机 |
(2)写出N的原子结构示意图__________,根据元素周期律知识,请写出氮化硅的化学式_________________。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式___________________________________。
(4)现用四氯化硅与氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为_____________________________________。