题目内容
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H=-169kJ·mol-1,
C(s)+1/2O2(g)=CO(g);△H=-110.5kJ·mol-1,
Cu(s)+1/2O2(g)=CuO(s);△H=-157kJ·mol-1
用炭粉在高温条件下还原CuO生成Cu2O的热化学方程式是:
(2)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g),写出该反应的化学平衡常数表达式:
2SO3(g),写出该反应的化学平衡常数表达式:
(3)以甲烷、空气为反应物,KOH溶液作电解质溶液构成燃料电池,则负极反应式为: 。
(4)铁在潮湿的空气中发生吸氧腐蚀的电池反应方程式为 。
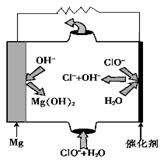
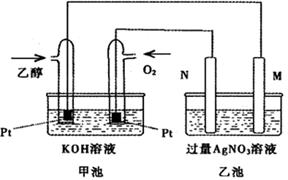
(5)“镁—次氯酸盐”燃料电池,其装置示意图如图,该电池反应的总反应方程式为_______________。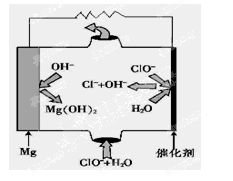
(6)工业上电解熔融氯化钠的方程式为 。
(1)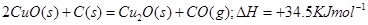
(2)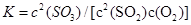
(3)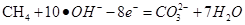
(4)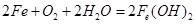
(5)Mg+ClO-+H2O=Mg(OH)2↓+Cl-
(6)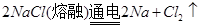
解析试题分析:(1)由盖斯定律,可知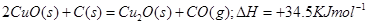
(2)根椐平衡常数的定义知: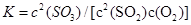
(3)甲烷被氧化,失去电子;电极反应式的书写要求,质量守恒,电荷守恒。
(4)铁在空气中接触氧气和水,被氧化为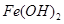 ;
;
(5)先写出电极反应方程式:
负极:Mg-2e-=Mg2+
正极:ClO-+2e-+H2O=Cl-+2OH-
因此总反应为:Mg+ClO-+H2O=Mg(OH)2↓+Cl-
(6)电解熔融的氯化钠:阴极:2Na++2e-=Na;阳极:2Cl――2e-=Cl2↑
总的反应为:2NaCl(熔融) 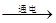 Na+Cl2↑
Na+Cl2↑
考点:考查实验问题。

化工行业的发展必须符合国家节能减排的总体要求。请回答下列问题:
(1)已知C(s)+H2O(g)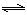 CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。
(2)已知在一定温度下,
C(s)+CO2(g) 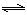 2CO(g) △H1
2CO(g) △H1
CO(g)+H2O(g) 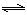 H2(g)+CO2(g) △H2
H2(g)+CO2(g) △H2
C(s)+H2O(g)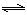 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
则△H1、△H2、△H3之间的关系是: 。
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g) 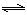 H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
则该反应的正反应方向是 反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g)
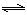 2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :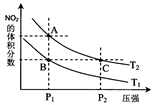
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
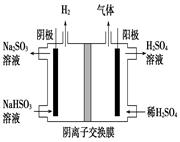
(5)工业上用Na2SO3吸收尾气中的SO2,再用下图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为: ,阳极区逸出气体的成分为 (填化学式)。
硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在。
(1)已知:①Na2SO4(s)=Na2S(s)+2O2(g) ; ΔH1=" +1011.0" kJ · mol-1
②C(s)+O2(g)=CO2(g) ; ΔH2=-393.5 kJ · mol-1
③2C(s)+O2(g)="2CO(g)" ;ΔH3=-221.0 kJ · mol-1
则反应④Na2SO4(s)+4C(s)=Na2S(s)+4CO(g);ΔH4= kJ · mol-1,该反应能自发进行的原因是 ;工业上制备Na2S不用反应①,而用反应④的理由是 。
(2)已知不同温度下2SO2+O2 2SO3的平衡常数见下表。
2SO3的平衡常数见下表。
| 温度(℃) | 527 | 758 | 927 |
| 平衡常数 | 784 | 1.0 | 0.04 |
1233℃时,CaSO4热解所得气体的主要成分是SO2和O2,而不是SO3的原因是 。
(3)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 。
②将上述反应获得的SO2通入含PtCl42-的酸性溶液,可还原出Pt,则反应的离子方程式是 。
③由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图,则正极的电极反应式为 。
I.已知:反应①H2(g) + Cl2(g) = 2HCl(g) ΔH=" —184" kJ/mol
②4HCl(g)+O2(g)  2Cl2(g)+2H2O(g) ΔH=" —115.6" kJ/mol
2Cl2(g)+2H2O(g) ΔH=" —115.6" kJ/mol 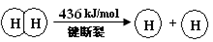
请回答:
(1)H2与O2反应生成气态水的热化学方程式
(2)断开1 mol H—O 键所需能量约为 kJ。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 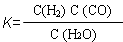 ,它所对应的化学方程式为: 。
,它所对应的化学方程式为: 。
(2)已知在400℃时,N2 (g)+ 3H2(g)  2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
2NH3(g) △H<0 的K="0.5," 则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g) + 3B(g)  2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
2C(g) + D(s) ΔH,其化学平衡常数K与温度t的关系如下表:
| t/K | 300 | 400 | 500 | … |
| K/(mol·L-1)2 | 4×106 | 8×107 | K1 | … |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I. 已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+ 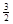 O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1 反应:Fe2O3(s)+ 3CO(g)
反应:Fe2O3(s)+ 3CO(g) 2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ. 反应 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
 Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=____________.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g) CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题: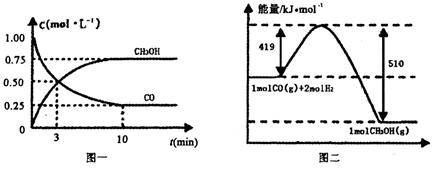
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________.
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是________.
A.c1=c2
B.2Q1=Q3
C.2a1=a3
D.a1 +a2 =1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式______________________.
从能量的变化和反应的快慢等角度研究反应: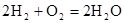 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
| A.使用催化剂 | B.适当提高氧气的浓度 |
| C.适当提高反应的温度 | D.适当降低反应的温度 |
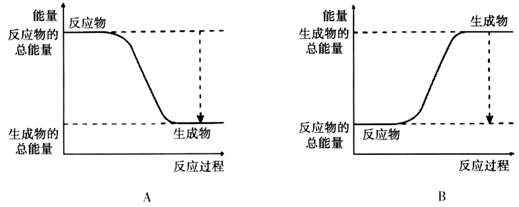
(3)从断键和成键的角度分析上述反应中能量的变化。
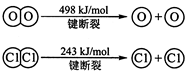
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
②化学键的键能:
| 化学键 | H—H | O=O | H—O |
键能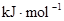 | 436 | 496 | 463 |
请填写下表:
| 化学键 | 填“吸收热量” 或“放出热量” | 能量变化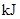 | |
| 拆开化学键 | 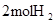 中的化学键 中的化学键 | _______________ | _______________ |
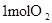 中的化学键 中的化学键 | |||
| 形成化学键 | 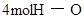 键 键 | _______________ | _______________ |
| 总能量变化 | _______________ | _______________ | |
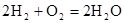 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。 
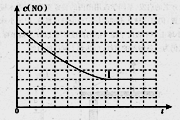
 N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下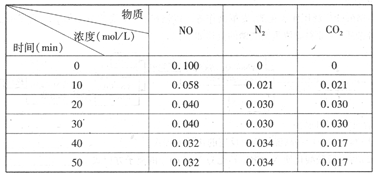
 N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。