题目内容
【题目】氨和联氨(N2H4)既是一种工业原料,又是一种重要的工业产品.
(1)实验室可用氯化铵与消石灰反应制取氨气,其反应的化学方程式为 .
(2)联氨在一定条件下可按下式分解:3N2H4(g)=N2(g)+4NH3(g),已知断裂1molN﹣H、N﹣N及N≡N需吸收的能量依次为390.8kJ、193kJ、946kJ.若生成1molN2 , 则反应(填“放出”或“吸收”)kJ的能量.
(3)NH3﹣O2燃料电池的结构如图所示. 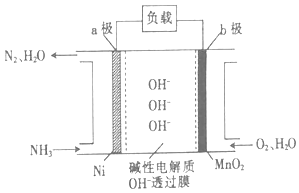
①a极为电池的(填“正”或“负”)极.
②当生成1molN2时,电路中流过电子的物质的量为 .
(4)联氨可以高效地脱除烟道气中的NO从而生成N2 , 该反应中氧化产物与还原产物的物质的量之比为 .
【答案】
(1)2NH4+Ca(OH)2 ![]() 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)放出;367
(3)负;6mol
(4)1:1
【解析】解:(1)实验室可用氯化铵与消石灰反应制取氨气,其反应的化学方程式为:2NH4+Ca(OH)2 ![]() 2NH3↑+CaCl2+2H2O,所以答案是:2NH4+Ca(OH)2
2NH3↑+CaCl2+2H2O,所以答案是:2NH4+Ca(OH)2 ![]() 2NH3↑+CaCl2+2H2O;(2)联氨在一定条件下可按下式分解:3N2H4(g)=N2(g)+4NH3(g),已知断裂1molN﹣H、N﹣N及N≡N需吸收的能量依次为390.8kJ、193kJ、946kJ.若生成1molN2 , 反应焓变△H=3×(193kJ/mol+390.8kJ×4KJ/mol)﹣946kJ/mol﹣4×3×390.8kJ/mol=﹣367KJ/mol,
2NH3↑+CaCl2+2H2O;(2)联氨在一定条件下可按下式分解:3N2H4(g)=N2(g)+4NH3(g),已知断裂1molN﹣H、N﹣N及N≡N需吸收的能量依次为390.8kJ、193kJ、946kJ.若生成1molN2 , 反应焓变△H=3×(193kJ/mol+390.8kJ×4KJ/mol)﹣946kJ/mol﹣4×3×390.8kJ/mol=﹣367KJ/mol,
所以答案是:放出;367;(3)该燃料电池中负极反应为:2NH3﹣6e﹣+6OH﹣═N2+6H2O,正极反应为:O2+4e﹣+2H2O=4OH﹣ , 则电池总反应为:4NH3+3O2═2N2+6H2O,①a极通入燃料为负极,负极上是燃料氨发生失电子的氧化反应,负极反应为:2NH3﹣6e﹣+6OH﹣═N2+6H2O,
所以答案是:负;②负极反应为:2NH3﹣6e﹣+6OH﹣═N2+6H2O,生成1mol氮气单质转移6mol,所以答案是:6mol;(4)联氨可以高效地脱除烟道气中的NO从而生成N2 , 反应的化学方程式为:N2H4+2NO=2N2+2H2O,反应中NO中氮元素化合价+2价变化为0价,得到还原产物,N2H4被氧化得到氮气为氧化产物,则反应中氧化产物与还原产物的物质的量之比为1:1,
所以答案是:1:1.
【考点精析】利用反应热和焓变对题目进行判断即可得到答案,需要熟知在化学反应中放出或吸收的热量,通常叫反应热.