��Ŀ����
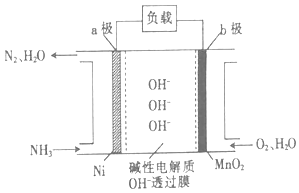
����Ŀ���������岻��ȱ�ٵ���Ԫ�أ������������壨FeSO47H2O����ҽҩ������Ѫ����ij����С��ⶨ�ò�Ѫ������Ԫ�صĺ�����������ò�Ѫ���Ƿ���ʣ�ʵ�鲽����ͼ�� 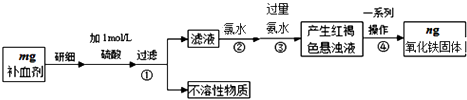
��1��ʵ�������Ѿ�ȷ��ȡ��Ũ��������500mL 1molL��1��������Һ��������ʱ�õ����������ձ����������⣬�������������� �� ��
��2������ڼ��������ˮ�������� �� ��Ӧ�����ӷ���ʽΪ ��
��3���������һϵ�в�������Ϊ��ϴ�ӡ����ա���ȴ��������
��4����ʵ������ģ���ò�Ѫ������Ԫ�ص���������Ϊ ��
��5�����в����ᵼ�����ⶨ����Ԫ�غ���ƫ�ߵ��� A����������Ӱ�ˮ������
B�������ϴ�Ӳ����
C����������ղ���֣�
��6��ijͬѧ���ֲ��ֲ�Ѫ��ҩƬ���淢�ƣ�ȡ��Ʒ��ϸ������1molL��1��������Һ�����ˣ�ȡ��Һ����Һ������Һ���ɫ��˵���ò�Ѫ���ѱ��ʣ�
���𰸡�
��1��500mL����ƿ����ͷ�ι�
��2����Fe2+ȫ������ΪFe3+��2Fe2++Cl2=2Fe3++2Cl��
��3������
��4��![]() %
%
��5��B��C
��6��KSN����
���������⣺������ͼ��֪����ʵ��ԭ��Ϊ����ҩƷ�е�Fe2+�γ���Һ����Fe2+����ΪFe3+ �� ʹFe3+ת��Ϊ����������������ת��Ϊ��������ͨ���ⶨ�����������������㲹Ѫ������Ԫ�صĺ�������1������Ͳ��ȡŨ������������ձ���ϡ�ͣ����ò��������裬��ȴ������500mL����ƿ�У�ϴ�ӡ���ˮ���ݣ�����̶���1��2cm���ý�ͷ�ιܣ�����ʱ�õ����������ձ����������⣬�������������ǣ�500mL����ƿ����ͷ�ιܣ����Դ��ǣ�500mL����ƿ����ͷ�ιܣ���2�������������ˮ��Fe2+��ȫ����ΪFe3+ �� ��Ӧ���ӷ���ʽΪ��2Fe2++Cl2=2Fe3++2Cl�� �� ���Դ��ǣ���Fe2+ȫ������ΪFe3+��2Fe2++Cl2=2Fe3++2Cl������3���������һϵ�д�������������������Һ����ת��Ϊ����������Ҫ���ˡ�ϴ�ӵ�����������Ȼ��������������������ȴ����������������������Դ��ǣ�ϴ�ӣ���4�����������Ϊag��������������Ԫ�ص�����Ϊ ![]() ��n g=0.7n g���ʲ�Ѫ������Ԫ�ص���������Ϊ
��n g=0.7n g���ʲ�Ѫ������Ԫ�ص���������Ϊ ![]() ��100%=
��100%= ![]() %�����Դ��ǣ�
%�����Դ��ǣ� ![]() %����5��A����������Ӱ�ˮ�����㣬�����Ӳ�����ȫת��Ϊ���������������ⶨ������������ƫС������Ԫ����������ƫС����A�����ϣ�B�������ϴ�Ӳ���֣����������ḽ�����ʣ��ⶨ������������ƫ����Ԫ����������ƫ�ߣ���B���ϣ�C����������ղ���֣����������ֽⲻ��ȫ���ⶨ������������ƫ����Ԫ����������ƫ�ߣ���C���ϣ���ѡ��BC����6����Ѫ������ʱFe2+������ΪFe3+ �� ���˺�ȡ��Һ��KSCN��Һ������Һ��ɺ�ɫ��˵���ò�Ѫ���ѱ��ʣ����Դ��ǣ�KSCN���죮
%����5��A����������Ӱ�ˮ�����㣬�����Ӳ�����ȫת��Ϊ���������������ⶨ������������ƫС������Ԫ����������ƫС����A�����ϣ�B�������ϴ�Ӳ���֣����������ḽ�����ʣ��ⶨ������������ƫ����Ԫ����������ƫ�ߣ���B���ϣ�C����������ղ���֣����������ֽⲻ��ȫ���ⶨ������������ƫ����Ԫ����������ƫ�ߣ���C���ϣ���ѡ��BC����6����Ѫ������ʱFe2+������ΪFe3+ �� ���˺�ȡ��Һ��KSCN��Һ������Һ��ɺ�ɫ��˵���ò�Ѫ���ѱ��ʣ����Դ��ǣ�KSCN���죮

 Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д�
Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д� �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д�