题目内容
9.能影响水的电离平衡,最终使水电离的离子在溶液中表现为c(OH-)>c(H+)的操作是( )| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中通入二氧化碳气体 | D. | 向水中加醋酸钠晶体 |
分析 使水电离的离子在溶液中表现为c(OH-)>c(H+),即加入物质结合水电离出的氢离子,再根据影响水的电离的因素:温度、同离子效应、所加物质的酸碱性等具体分析水的电离平衡的移动.
解答 解:A、加入金属钠,和水电离出的氢离子反应生成氢氧化钠和氢气,氢离子浓度降低,使水的电离向右移动,但是由水电离出的c(H+)=c(OH-),故A错误;
B、加热时促进水的电离,但是由水电离出的氢离子和氢氧根浓度依然相等,故B错误;
C、二氧化碳溶于水形成碳酸,水的电离受到抑制,但是由水电离出的c(H+)=c(OH-),故C错误;
D、向水中加醋酸钠晶体,由于醋酸根水解,结合水电离出的氢离子形成弱酸(醋酸),导致水电离出的离子在溶液中表现为c(OH-)>c(H+),故D正确,
故选D.
点评 本题主要考查的是学生水的电离的影响因素的判断,正确掌握只有盐类水解才能导致水电离出的氢离子或者氢氧根被结合,导致水电离的离子表现不平衡.

练习册系列答案
相关题目
19.下列说法中正确的一组是( )
| A. | 1H2和2H2互为同位素 | |
| B. | CH3-CH2-OH与CH3-O-CH3互为同分异构体 | |
| C. | 乙烯和乙炔是同系物 | |
| D. | ${\;}_{8}^{16}O$、${\;}_{8}^{17}O$、${\;}_{8}^{18}O$互为同素异形体 |
20.某鱼雷采用Al-Ag2O动力电池,以溶解有氢氧化钾的流动海水为电解液,电池反应为:2Al+3Ag2O+2KOH═6Ag+2KAlO2+H2O,下列说法不正确的是( )
| A. | Ag2O为电池的正极 | B. | Al在电池反应中被氧化 | ||
| C. | 电子由Ag2O极经外电路流向Al极 | D. | 溶液中的OH-向Al极迁移 |
17.下列过程吸收热量的是( )
| A. | 硝酸铵和适量的水混合 | B. | 氧化钙和适量的水混合 | ||
| C. | 稀盐酸与金属镁反应 | D. | 汽油在空气中燃烧 |
4.下列有关乙酸的说法中不正确的是( )
| A. | 冰和乙酸的混合物俗称冰醋酸 | |
| B. | 具有酸的通性 | |
| C. | 酸性比碳酸的酸性强 | |
| D. | 与乙醇反应生成的有机物是乙酸乙酯 |
14.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于( )
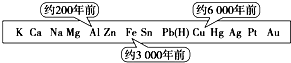

| A. | 金属的导电性强弱 | B. | 金属在地壳中的含量多少 | ||
| C. | 金属的活动性大小 | D. | 金属的化合价高低 |
1.某有机物的结构如图所示: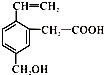 ,这种有机物可能具有的性质是①能发生加成反应、②能使酸性KMnO4溶液褪色、③能跟NaOH溶液反应、④能发生酯化反应、⑤能发生加聚反应( )
,这种有机物可能具有的性质是①能发生加成反应、②能使酸性KMnO4溶液褪色、③能跟NaOH溶液反应、④能发生酯化反应、⑤能发生加聚反应( )
 ,这种有机物可能具有的性质是①能发生加成反应、②能使酸性KMnO4溶液褪色、③能跟NaOH溶液反应、④能发生酯化反应、⑤能发生加聚反应( )
,这种有机物可能具有的性质是①能发生加成反应、②能使酸性KMnO4溶液褪色、③能跟NaOH溶液反应、④能发生酯化反应、⑤能发生加聚反应( )| A. | 只有②③④ | B. | 只有①②③ | C. | 全部 | D. | 只有②④⑤ |
4.下列广告对应商品中含有的化学物质正确的是( )
| A. | “莲花味精、领先(鲜)一步”--蛋白质 | |
| B. | “何以解优,唯有杜康”--乙醇 | |
| C. | “盖中盖片高钙片,吸收好”--硫酸钙 | |
| D. | “恒源祥,羊羊羊”--纤维素 |