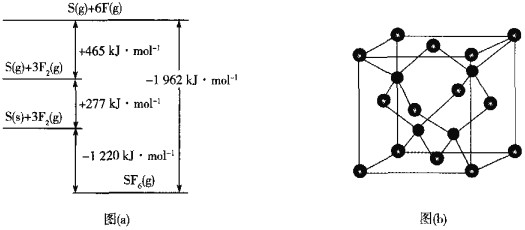
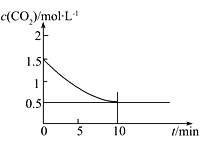
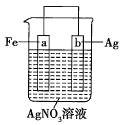
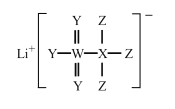题目内容
【题目】室温下,向20.00mL 0.1000mol·L1盐酸中滴加0.1000mol·L1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图,已知lg3=0.5,邻苯二甲酸为弱酸。下列说法不正确的是( )
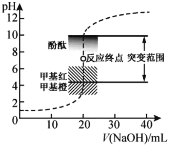
A.选择变色范围在pH突变范围内的指示剂,可减小实验误差
B.用酸式滴定管量取20.00mL 0.1000mol·L1盐酸时,酸式滴定管水洗后需用待取液润洗
C.NaOH标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钠标定NaOH溶液的浓度,标定时采用甲基橙为指示剂
D.V(NaOH)=10.00mL 时,pH约为1.5
【答案】C
【解析】
A. 选择变色范围在pH突变范围内的指示剂,可以较准确得到NaOH标准溶液的消耗体积,减小实验误差,故A正确;
B. 用酸式滴定管量取20.00mL 0.1000mol·L1盐酸时,酸式滴定管水洗后,必需用待取液润洗,否则会稀释盐酸溶液,导致所测结果偏低,故B正确;
C. 邻苯二甲酸氢钠与NaOH溶液恰好反应生成邻苯二甲酸钠,由邻苯二甲酸为弱酸可知邻苯二甲酸钠溶液呈碱性,则用邻苯二甲酸氢钠标定NaOH溶液的浓度时应采用酚酞为指示剂,选用甲基橙会使所测结果偏低,故C错误;
D. V(NaOH)=10.00mL 时,盐酸过量,溶液中氢离子浓度为![]() mol/L,则溶液pH=1+lg3=1.5,故D正确;
mol/L,则溶液pH=1+lg3=1.5,故D正确;
故选C。

【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
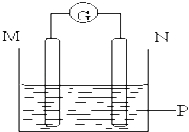
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D
【题目】滴定实验是化学学科中重要的定量实验。请回答下列问题:
I.酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
(1)该学生的实验操作如下:
a.用碱式滴定管取稀NaOH 25.00 mL,注入锥形瓶中,加入甲基橙作指示剂。
b.用待测定的溶液润洗碱式滴定管。
c.用蒸馏水洗干净滴定管。
d.取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3 cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
e.检查滴定管是否漏水。
f.另取锥形瓶,再重复操作一次。
g.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)___________________。
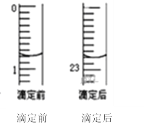
②某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
仪器A的名称是_____________;盐酸的体积读数:滴定前读数为____mL,滴定后读数为____mL;
③在g操作中如何确定终点________________。
(2)下列操作造成测定结果偏高的是______(填选项字母)。
A.滴定终点时,俯视滴定管溶液液面
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
II.氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1 mol/L的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
(1)滴定时,KMnO4溶液应装在___(“酸”或“碱”)式滴定管中,滴定终点时锥形瓶内的颜色变化是___。
(2)该草酸溶液的物质的量浓度为__________。