题目内容
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下: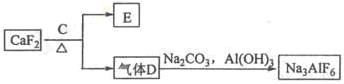
回答下列问题:
(1)写出反应1的化学方程式 ;
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为 ;
(3)E可作为建筑材料,化合物C是 ,写出由D制备冰晶石的化学方程式 ;
(4)电解制铝的化学方程式是 ,以石墨为电极,阳极产生的混合气体的成分是 。
(1)2NaOH+SiO2=Na2SiO3+H2O 2NaOH+Al2O3=2NaAlO2+H2O
(2)CaSiO3 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(3)浓H2SO4 12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O(4)2Al2O3 4Al+3O2↑ O2、 CO2 、CO
4Al+3O2↑ O2、 CO2 、CO
解析试题分析:(1)铝土矿的主要成分是Al2O3和SiO2等.当向铝土矿中加入氢氧化钠溶液时发生反应2NaOH+SiO2=Na2SiO3+H2O 2NaOH+Al2O3=2NaAlO2+H2O。产生的Na2SiO3和NaAlO2在滤液Ⅰ中。向滤液中加入CaO发生反应CaO+H2O=Ca(OH)2 Ca(OH)2+ Na2SiO3=CaSiO3↓+2NaOH. NaAlO2仍然留在滤液Ⅱ中。这时通入CO2气体。发生反应:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-。B是Al(OH)3。滤液Ⅲ含有碳酸钠。Al(OH)3受热分解2 Al(OH)3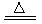 Al2O3+3H2O. 电解氧化铝得到单质Al。由于Al2O3熔点很高,有2000多度。为了能使氧化铝在较低的温度下融化,要加入助溶剂冰晶石。它的制法是用萤石和浓硫酸在加热时发生反应硫酸钙和HF。硫酸钙用于建筑材料,由HF和碳酸钠、氢氧化铝发生反应产生冰晶石。12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O。这样在冰晶石作用下1000度左右氧化铝就能融化,发生反应:2Al2O3
Al2O3+3H2O. 电解氧化铝得到单质Al。由于Al2O3熔点很高,有2000多度。为了能使氧化铝在较低的温度下融化,要加入助溶剂冰晶石。它的制法是用萤石和浓硫酸在加热时发生反应硫酸钙和HF。硫酸钙用于建筑材料,由HF和碳酸钠、氢氧化铝发生反应产生冰晶石。12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O。这样在冰晶石作用下1000度左右氧化铝就能融化,发生反应:2Al2O3 4Al+3O2↑。制的Al. 以石墨为电极电解氧化铝时,阳极发生氧化反应产生氧气。但由于温度高,部分氧气和石墨电极发生反应产生CO、CO2.故阳极产生的混合气体的成分是O2、CO2 CO.
4Al+3O2↑。制的Al. 以石墨为电极电解氧化铝时,阳极发生氧化反应产生氧气。但由于温度高,部分氧气和石墨电极发生反应产生CO、CO2.故阳极产生的混合气体的成分是O2、CO2 CO.
考点:考查氧化铝、冰晶石的制备及铝的冶炼的知识。

 应用题作业本系列答案
应用题作业本系列答案(1)有一瓶存放时间较长的硫酸亚铁,外观上并无明显变化,但某学生怀疑其有部分因氧化而变质,请你设计1个检验硫酸亚铁是否变质的实验方案: 。如果有变质,当配制硫酸亚铁溶液时,应如何除去变质的杂质? 。
(2)FeCl3溶液棕黄色,对此溶液,分别做如下实验,请填表:
| 编号 | 实践操作 | 实验主要现象 | 离子方程式 |
| ① | 加入过量铁粉 | | |
| ② | 加入少量Na2O2粉末 | | |
| ③ | 加入少量AgNO3溶液 | | |
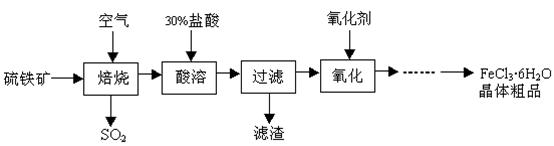
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: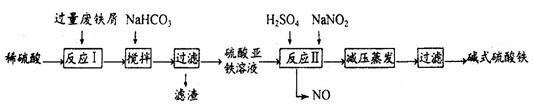
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)反应I溶液中存在的金属阳离子有__________________。
(2)加入NaHCO3的目的是调节pH,使溶液中的______(填“Fe3+”、“Fe2+”或“A13+”)沉淀。该工艺流程中“搅拌”的作用是_____________。
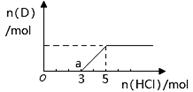
(3)反应II的离子方程式为__________。在实际生产中,反应II常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作为________。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2物质的量为__________。
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为__________________________。
目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。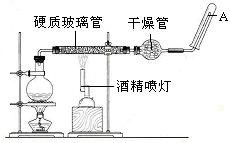
请回答下列的问题。
铁在周期表中的位置是_______
请写出该反应的化学方程式: ;
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为
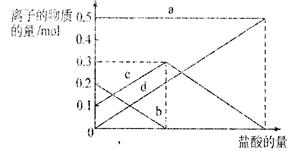
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
| | ① | ② | ③ | ④ |
| 溶液中的金属离子 | | Fe2+ | | |
| 残留固体成分 | Fe、Pt | | Pt | Pt |
②当x="0.5" ,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mLNO。
则a = ,b = ,
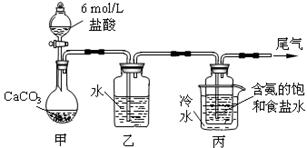
 某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装
某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装