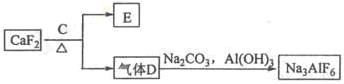
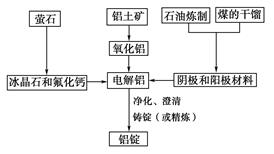
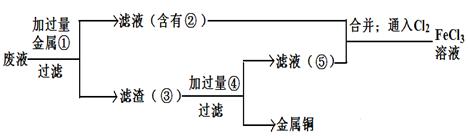
题目内容
(1)有一瓶存放时间较长的硫酸亚铁,外观上并无明显变化,但某学生怀疑其有部分因氧化而变质,请你设计1个检验硫酸亚铁是否变质的实验方案: 。如果有变质,当配制硫酸亚铁溶液时,应如何除去变质的杂质? 。
(2)FeCl3溶液棕黄色,对此溶液,分别做如下实验,请填表:
| 编号 | 实践操作 | 实验主要现象 | 离子方程式 |
| ① | 加入过量铁粉 | | |
| ② | 加入少量Na2O2粉末 | | |
| ③ | 加入少量AgNO3溶液 | | |
(1)取少量硫酸亚铁样品盛于试管,加蒸馏水使之溶解,滴入几滴KSCN溶液,若溶液呈血红色,说明样品有变质,若溶液不呈红色,则未变质(2分)。
配制硫酸亚铁溶液时,在溶液中加入少量还原铁粉(1分) (2)(各1分 ,共7分)编号 实验操作 实验主要现象 离子方程式 ① 加入过量铁粉 铁粉部分溶解,溶液由棕黄色变浅绿色 2Fe3++Fe=3Fe2+ ② 加入少量
Na2O2粉末生成红褐色沉淀并放出无色无味气体 2Na2O2+2H2O=4Na++4OH-+O2↑
Fe3++3OH-=Fe(OH)3↓③ 加入少量
AgNO3溶液生成白色沉淀 Ag++Cl-=AgCl↓
解析试题分析:(1)亚铁离子极易被氧化生成铁离子,而铁离子能和KSCN溶液反应使溶液显红色,据此可以检验,因此正确的实验操作是取少量硫酸亚铁样品盛于试管,加蒸馏水使之溶解,滴入几滴KSCN溶液,若溶液呈血红色,说明样品有变质,若溶液不呈红色,则未变质;由于铁离子能和铁单质反应生成亚铁离子,所以要防止亚铁离子被氧化,则配制硫酸亚铁溶液时,在溶液中加入少量还原铁粉即可。
(2)铁离子具有氧化性,能氧化单质铁,所以氯化铁溶液中加入铁粉时的实验现象是铁粉部分溶解,溶液由棕黄色变浅绿色,反应的离子方程式为2Fe3++Fe=3Fe2+;过氧化钠反应热生成氢氧化钠和氧气,生成的氢氧化钠和氯化铁反应生成红褐色氢氧化铁沉淀,因此实验现象是生成红褐色沉淀并放出无色无味气体,反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑、Fe3++3OH-=Fe(OH)3↓;氯化铁溶液中的氯离子能和硝酸银反应生成白色沉淀氯化银,反应的离子方程式为Ag++Cl-=AgCl↓。
考点:考查铁离子、亚铁离子、过氧化钠的性质、检验以及离子方程式的书写

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。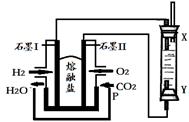
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
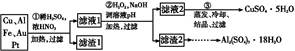
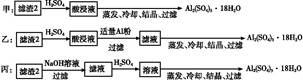
 CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;  xH2O)。有如下操作:
xH2O)。有如下操作: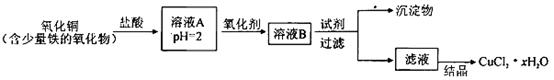

 的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题: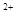 、Cu
、Cu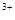 与Fe
与Fe