题目内容
【题目】试回答下列各问题:
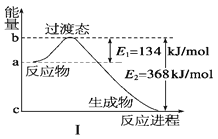
(1)如图Ⅰ所示是1mol NO2和CO反应生成 CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:____________________________________________________________.
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJ/mol;
键能E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=247kJ/mol,则E(H﹣Cl)=_________________.
(3)已知:
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣a kJ/mol
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=﹣b kJ/mol
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+ckJ/mol
则FeO(s)+CO(g)═Fe(s)+CO2(g)△H=_______________
【答案】 NO2(g)+CO(g)=NO(g)+CO2(g)△H=﹣234 kJmol﹣1 434KJ/mol ![]() KJ/mol
KJ/mol
【解析】(1)根据图Ⅰ可知反应物的总能量高于生成物的总能量,是放热反应,1mol NO2和CO反应生成 CO2和NO过程中放出的热量是368kJ-134 kJ=234 kJ,所以热化学方程式为NO2(g)+CO(g) == NO(g)+CO2(g)ΔH=-234 kJ/mol。
(2)①反应热就是断键吸收的能量和形成化学键所放出的能量的差值,因此
ΔH==436kJ/mol+247 kJ/mol-2X=-185 kJ/mol,解得X=434 kJ/mol。
(3) 根据盖斯定律可知,①×3-②-③×2即得到6FeO(s) +6CO(g)![]() 6Fe(s)+6CO2(g),所以反应热为ΔH= (3a-b+2c)kJ/mol。FeO(s)+CO(g)═Fe(s)+CO2(g)△H=(3a-b+2c)/6kJ/mol。
6Fe(s)+6CO2(g),所以反应热为ΔH= (3a-b+2c)kJ/mol。FeO(s)+CO(g)═Fe(s)+CO2(g)△H=(3a-b+2c)/6kJ/mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】苯佐卡因(对氨基苯甲酸乙酯)常用于创面、溃疡面及痔疮的镇痛。在实验室用对氨基苯甲酸(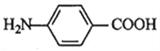 )与乙醇反应合成苯佐卡因,有关数据和实验装置图如下:
)与乙醇反应合成苯佐卡因,有关数据和实验装置图如下:
相对分子质量 | 密度(g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 | |
乙醇 | 46 | 0.79 | -114.3 | 78.5 | 与水任意比互溶 |
对氨基苯甲酸 | 137 | 1.374 | 188 | 399.9 | 微溶于水,易溶于乙醇 |
对氨基苯甲酸乙酯 | 165 | 1.039 | 90 | 172 | 难溶于水,易溶于醇、醚类 |
产品合成: 在250mL圆底烧瓶中加入8.2g对氨基苯甲酸(0.06mol) 和80mL无水乙醇(约1.4mol),振荡溶解,将烧瓶置于冰水浴并加入10mL浓硫酸,将反应混合物在80℃水浴中加热回流1h,并不时振荡。
分离提纯: 冷却后将反应物转移到400mL烧杯中,分批加入10%Na2CO3溶液直至pH=9,转移至分液漏斗中,用乙醚(密度0.714g·cm-3) 分两次萃取,并向醚层加入无水硫酸镁,蒸出醚层,冷却结晶,最终得到产物3.3g。
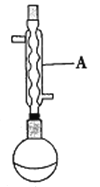
(1)仪器A的名称为______,在合成反应进行之前,圆底烧瓶中还应加入适量的______。
(2) 该合成反应的化学方程式是______ 。
(3)将烧瓶置于冰水浴中的目的是______ 。
(4)分液漏斗使用之前必须进行的操作是_______,乙醚层位于_______(填“上层”或“下层”);分离提纯操作加入无水硫酸镁的作用是_________。
(5)合成反应中加入远过量的乙醇目的是_________;分离提纯过程中加入10%Na2CO3溶液的作用是_________ 。
(6)本实验中苯佐卡因的产率为_________(保留3位有效数字)。该反应产率较低的原因是_________ (填标号)。
a.浓硫酸具有强氧化性和脱水性,导致副反应多 b.催化剂加入量不足
c.产品难溶于水,易溶于乙醇、乙醚 d.酯化反应是可逆反应