题目内容
【题目】偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述不正确的是( )
A. 偏二甲肼(C2H8N2)的摩尔质量为60g/mol
B. 6.02×1023个偏二甲肼分子的质量为60g
C. 1 mol偏二甲肼中共含有12mol原子
D. 6 g偏二甲肼含有NA个偏二甲肼分子
【答案】D
【解析】
A.偏二甲肼(C2H8N2)的摩尔质量为(12×2+1×8+14×2)g/mol=60g/mol,故A正确;B.6.02×1023个偏二甲肼的物质的量为1mol,所以1 mol 偏二甲肼的质量为60 g,故B正确;C.1mol偏二甲肼含有2molC,8molH和2molN,共12mol原子,故C正确;D.偏二甲肼的物质的量为![]() =0.1mol,含有的分子数为0.1×NA,故D错误;故选D。
=0.1mol,含有的分子数为0.1×NA,故D错误;故选D。

【题目】Ⅰ.(1)在2L定容密闭容器中通入1molN2(g)和3molH2(g),发生反应:
3H2(g)+N2(g)![]() 2NH3(g)△H<0,测得压强一时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g)△H<0,测得压强一时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
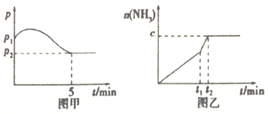
①若图中c=1.6mol,则改变的条件是__________(填字母,下同);
A.升温 B.降温 C.加压 D.减压 E.加催化剂
②若图中c<1.6mol,则改变的条件是__________(填字母);此时该反应的平衡常数__________(填“增大”、“减小”、“不变”)。
(2)如图甲,平衡时氢气的转化率为____________。
Ⅱ.粗制的CuCl2·2H2O晶体中常含有Fe3+、Fe2+杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
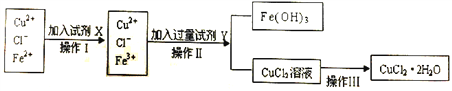
(1)操作Ⅰ时,常先加入合适的氧化剂,将Fe2+氧化为Fe3+,下列可选用的氧化剂是__________。
A.KMnO4 B.H2O2 C.Cl2 D.HNO3
(2)操作Ⅱ调整溶液的pH的Y试剂可选用下列中的__________。
A.NaOH(s) B.氨水 C.CuO(s) D.Cu(OH)2(s)
(3)已知溶度积常数如下表:
物质 | Cu(OH) | Fe(OH)2 | Fe(OH)3 |
Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
将溶液的pH调至pH=4时,使Fe3+完全转化为Fe(OH)3沉淀而除去,此时c(Fe3+)=__________。
(4)若将CuCl2溶液蒸干后,再灼烧,得到的固体是__________(填化学式);操作Ⅲ后由CuCl2·2H2O晶体得到纯净无水CuCl2的合理操作是_____________________________________。
【题目】向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应后,反应速率最快和最慢的容器编号分别是
容器编号 | 温度 | SO2的物质的量 | O2的物质的量 | 催化剂 |
甲 | 500 ℃ | 10 mol | 5 mol | - |
乙 | 500 ℃ | 10 mol | 5 mol | V2O5 |
丙 | 500 ℃ | 8 mol | 5 mol | - |
丁 | 450 ℃ | 8 mol | 5 mol | - |
A.甲、乙B.甲、丙C.乙、丁D.丙、丁
【题目】工业上利用氯碱工业中的固体废物盐泥(主要成分为Mg(OH)2、CaCO3、BaSO4,除此之外还有NaCl、Al(OH)3、Fe(OH)3、Mn(OH)2等。)与废稀硫酸反应制备七水硫酸镁,产率高,既处理了三废,又有经济效益。其工艺流程如下:

已知:
i)部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH值(完全沉淀) | 10.02 | 8.96 | 3.20 | 4.70 | 11.12 |
ii)两种盐的溶解度图(单位为g/100g水)
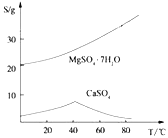
根据以上流程图并参考表格pH数据和溶解度图,请回答下列问题。
(1)酸解时,加入的酸为____________,在酸解过程中,想加快酸解速率,请提出两种可行的措施____________、____________。
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是____________。
(3)本工艺流程多次用到抽滤操作,其优点在于____________,四次抽滤时:抽滤①所得滤渣A的成分为____________、CaSO4;抽滤②所得滤渣B的成分为MnO2、____________、____________;抽滤③所得滤液C中主要杂质阳离子的检验方法是____________;抽滤④将产品抽干。
(4)依据溶解度曲线,操作M应采取的方法是适当浓缩,____________。
(5)每制备1吨MgSO4·7H2O,需要消耗盐泥2吨。若生产过程中的转化率为70%,则盐泥中镁(以氢氧化镁计)的质量分数约为____________。