题目内容
9.下列各反应原理及其应用不正确的一项是( )| A. | SiO2+4HF=SiF4↑+2H2O;用氢氟酸蚀刻玻璃 | |
| B. | 4Na+TiCl4 $\frac{\underline{\;高温\;}}{\;}$4NaCl+Ti;用金属钠与熔融TiCl4反应制取金属Ti | |
| C. | CO32-+H2O?H2CO3+OH-;用热的纯碱溶液清洗餐具油污 | |
| D. | MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;工业上用电解熔融氯化镁制取金属镁 |
分析 A、用氢氟酸蚀刻玻璃,是因为二氧化硅与氢氟酸反应生成四氟化硅;
B、因为金属钠与熔融的盐反应中金属阳离子置换反应,所以用金属钠与熔融TiCl4反应制取金属Ti;
C、加热促进水解,所以用热的纯碱溶液清洗餐具油污,反应方程式为:CO32-+H2O?HCO3-+OH-;
D、工业上用电解熔融氯化镁制取金属镁,反应方程式为:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;
解答 解:A、用氢氟酸蚀刻玻璃,是因为二氧化硅与氢氟酸反应生成四氟化硅,反应方程式为:SiO2+4HF=SiF4↑+2H2O,故A正确;
B、因为金属钠与熔融的盐反应中金属阳离子置换反应,所以用金属钠与熔融TiCl4反应制取金属Ti,反应方程式为:4Na+TiCl4 $\frac{\underline{\;高温\;}}{\;}$4NaCl+Ti,故B正确;
C、加热促进水解,所以用热的纯碱溶液清洗餐具油污,反应方程式为:CO32-+H2O?HCO3-+OH-,故C错误;
D、工业上用电解熔融氯化镁制取金属镁,反应方程式为:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,故D正确;
故选C.
点评 本题考查元素化合物的性质及应用,学生只要熟悉元素化合的性质即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
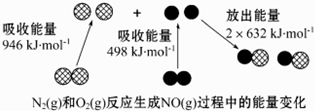
19.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化.下列说法正确的是( )
( )
( )

| A. | 通常情况下,N2(g)和 O2混合能直接生成NO(g) | |
| B. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 | |
| C. | 1 mol N2(g)和1mol个 O2(g)反应放出的能量为180 kJ | |
| D. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
20.某小组设计如图装置研究电化学原理,下列说法中错误的是( )
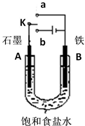

| A. | 若开始时开关K与a连接,其反应与铁的吸氧腐蚀类似 | |
| B. | 若开始时开关K与b连接,其原理类似于钢铁防护中外加电流的阴极保护法 | |
| C. | 若开始时开关K与b连接,则标准状况下B极产生2.24 L气体,转移电子0.2 mol | |
| D. | 若开始时开关K与b连接,则反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同) |
4.设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的是( )
| A. | 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L | |
| B. | 标准状况下,4.0 g CH4中含有共价键的数目为NA | |
| C. | 1 mol C12发生化学反应,转移的电子数必为2NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
14.有机物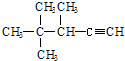 的系统名称为( )
的系统名称为( )
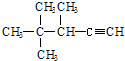 的系统名称为( )
的系统名称为( )| A. | 2,2,3-三甲基-1-戊炔 | B. | 3,4,4-三甲基-4-戊炔 | ||
| C. | 3,4,4-三甲基-1-戊炔 | D. | 2,2,3-三甲基-4-戊炔 |
18. 最新的数据显示,北京雾霾颗粒中机动车尾气占22.2%,燃煤占16.7%,扬尘占16.3%,工业占15.7%.据分析六大主要雾霾贡献源如图所示.下列措施不可能改善空气质量的是( )
最新的数据显示,北京雾霾颗粒中机动车尾气占22.2%,燃煤占16.7%,扬尘占16.3%,工业占15.7%.据分析六大主要雾霾贡献源如图所示.下列措施不可能改善空气质量的是( )
 最新的数据显示,北京雾霾颗粒中机动车尾气占22.2%,燃煤占16.7%,扬尘占16.3%,工业占15.7%.据分析六大主要雾霾贡献源如图所示.下列措施不可能改善空气质量的是( )
最新的数据显示,北京雾霾颗粒中机动车尾气占22.2%,燃煤占16.7%,扬尘占16.3%,工业占15.7%.据分析六大主要雾霾贡献源如图所示.下列措施不可能改善空气质量的是( )| A. | 应用高效洁净的能源转换技术,在大型燃煤锅炉上安装低氮燃烧器,采用烟气脱硝技术 | |
| B. | 不放烟花焰火,加强道路扬尘污染控制,强化路面保洁,洒水防尘 | |
| C. | 在炼油厂.钢铁厂.发电厂等,推广和使用脱硫技术,降低硫氧化物的排放 | |
| D. | 研究采煤.采油新技术,增加汽油.柴油等能源的供应量,提倡以汽车代步的现代消费与生活理念 |
19.某学习小组利用图1装置制取乙酸乙酯.
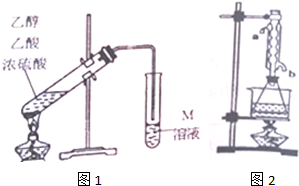
请回答下列问题:
(1)在图1制取装置中要加入碎瓷片,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是C(填正确选项字母).
A.重新配料 B.立即加补 C.冷却后加补 D.不需加补
(2)M溶液为Na2CO3(填化学式)溶液.装置中通蒸气的导管要插在饱和M溶液的液面上,不能插入溶液中,目的是防止M溶液倒吸,造成倒吸的原因是乙酸和乙醇都易溶于Na2CO3溶液.
(3)有同学认为改进图1的制取装置能提高乙酸乙酯产率.写出一条改进建议:加装水冷凝管,提高冷却效果;用圆底烧瓶(或三颈瓶)并加装温度计控制反应温度.
(4)图1装置制取的乙酸乙酯中混有少许乙醇和乙酸.通过下列实验可分析乙酸乙酯的含量,操作步骤如下:
①准确称量20.0g乙酸乙酯粗产品于锥形瓶中,用0.50mol•L-1NaOH滴定(酚酞做指示剂),终点时消耗NaOH溶液的体积为40.0mL
②另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL2.1mol•L-1NaOH溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时(装置如图2所示).待冷却后,用0.50mol•L-1HCl滴定过量的NaOH,终点时消耗盐酸的体积为20.0mL.实验②中冷水从冷凝管的b(选填a或b)管口通入.利用实验①、②测量的数据计算粗产品中乙酸乙酯的质量分数为79.2%.

| 相对分子质量 | 沸点(℃) | |
| 乙醇 | 46 | 78.5 |
| 乙酸 | 60 | 117.9 |
| 乙酸乙酯 | 88 | 77.1 |
(1)在图1制取装置中要加入碎瓷片,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是C(填正确选项字母).
A.重新配料 B.立即加补 C.冷却后加补 D.不需加补
(2)M溶液为Na2CO3(填化学式)溶液.装置中通蒸气的导管要插在饱和M溶液的液面上,不能插入溶液中,目的是防止M溶液倒吸,造成倒吸的原因是乙酸和乙醇都易溶于Na2CO3溶液.
(3)有同学认为改进图1的制取装置能提高乙酸乙酯产率.写出一条改进建议:加装水冷凝管,提高冷却效果;用圆底烧瓶(或三颈瓶)并加装温度计控制反应温度.
(4)图1装置制取的乙酸乙酯中混有少许乙醇和乙酸.通过下列实验可分析乙酸乙酯的含量,操作步骤如下:
①准确称量20.0g乙酸乙酯粗产品于锥形瓶中,用0.50mol•L-1NaOH滴定(酚酞做指示剂),终点时消耗NaOH溶液的体积为40.0mL
②另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL2.1mol•L-1NaOH溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时(装置如图2所示).待冷却后,用0.50mol•L-1HCl滴定过量的NaOH,终点时消耗盐酸的体积为20.0mL.实验②中冷水从冷凝管的b(选填a或b)管口通入.利用实验①、②测量的数据计算粗产品中乙酸乙酯的质量分数为79.2%.

 ,肉桂醛分子结构中有6种不同化学环境的氢原子.
,肉桂醛分子结构中有6种不同化学环境的氢原子.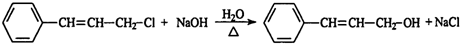 ,B转化为肉桂醛的反应条件为Cu/Ag加热.
,B转化为肉桂醛的反应条件为Cu/Ag加热. .
. .
.