题目内容
4.设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的是( )| A. | 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L | |
| B. | 标准状况下,4.0 g CH4中含有共价键的数目为NA | |
| C. | 1 mol C12发生化学反应,转移的电子数必为2NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
分析 A、依据电解原理和电极反应,结合电子守恒计算生成气体分析判断;
B、4.0g甲烷的物质的量为0.25mol,0.25mol甲烷中含有1mol共价键;
C、氯气与氢氧化钠溶液的反应中,1mol氯气完全反应转移了1mol电子;
D、I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,转移5e-;
解答 解:A、惰性电极电解食盐水,阳极电极反应为2Cl--2e-=Cl2↑,若电路中通过NA个电子物质的量为1mol,则阳极产生气体0.5mol,不一定是标准状况,气体体积不一定是11.2L,故A错误;
B、4g甲烷的物质的量为0.25mol,0.25mol甲烷中含有1mol共价键,含有共价键的数目为NA,故B正确;
C、氯气与金属的反应中,1mol氯气完全反应得到2mol电子,但氯气与氢氧化钠溶液的反应中,1mol氯气完全反应转移了1mol电子,所以1mol氯气发生的化学反应中,转移的电子的物质的量不一定为2mol,转移的电子数不一定为2NA,故C错误;
D、在反应KIO3+6HI=KI+3I2+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,生成3mo1I2转移的电子数为5NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,氧化还原反应电子转移计算,电解池原理的应用,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,注意气体摩尔体积适用对象及条件,题目难度中等.

练习册系列答案
相关题目
14.向明矾[KAl(SO4)2•12H2O]溶液中滴加Ba(OH)2溶液,当SO42-完全沉淀时,铝元素的存在形式是( )
| A. | 全部为Al(OH)3沉淀 | |
| B. | 几乎全部以AlO2-形式存在于溶液中 | |
| C. | 一部分为Al(OH)3沉淀,一部分以Al3+存在于溶液中 | |
| D. | 一部分为Al(OH)3沉淀,一部分以AlO3-形式存在于溶液中 |
12.下列表示正确的是( )
| A. | 含有大量AlO2-的溶液中:K+、NH4+、Br-、HSO3-可以大量共存 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ•mol-1 | |
| C. | 将少量SO2通入NaClO溶液中:2ClO-+SO2+H2O═SO32-+2HClO | |
| D. | 在某钠盐溶液中含等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但未见沉淀生成,则原溶液中一定有NO3-、I-和CO32- |
19.下列说法正确的是( )
| A. | 银氨溶液可用于检验淀粉是否发生水解 | |
| B. | 植物油的主要成分是高级脂肪酸 | |
| C. | 蔗糖及其水解产物均可发生银镜反应 | |
| D. | 鸡蛋清溶液中加入饱和硫酸钠溶液,生成的沉淀物不能再溶解 |
9.下列各反应原理及其应用不正确的一项是( )
| A. | SiO2+4HF=SiF4↑+2H2O;用氢氟酸蚀刻玻璃 | |
| B. | 4Na+TiCl4 $\frac{\underline{\;高温\;}}{\;}$4NaCl+Ti;用金属钠与熔融TiCl4反应制取金属Ti | |
| C. | CO32-+H2O?H2CO3+OH-;用热的纯碱溶液清洗餐具油污 | |
| D. | MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;工业上用电解熔融氯化镁制取金属镁 |
16.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 1mol C6H14分子中共价键总数为20NA | |
| B. | 1mol乙基(-CH2CH3)电子总数17NA | |
| C. | 常温常压下,26g苯乙烯和苯组成的混合物中所含有的碳原子数为4NA | |
| D. | 标准状况下,22.4L甲醇的分子数中所含羟基数为NA |
13.下列说法正确的是( )
| A. | 打开盛浓盐酸的试剂瓶可看到白色的酸雾,这说明HCl不稳定 | |
| B. | 蔗糖中滴入浓硫酸,蔗糖变黑,这说明浓硫酸是氧化性酸 | |
| C. | 向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- | |
| D. | 碳酸、亚硫酸和次氯酸都是不稳定性酸 |
14.碳及其化合物的开发利用已成为科学家研究的重要课题,在工农业生产和科学研究中有十分重要的地位.
Ⅰ:草酸钙晶体(CaC2O4•H2O)可用作分离稀有金属的载体.
(1)在一定温度下向1L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)?CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为11.2g,则该段时间内v(CO)=0.04mol•L-1•min-1;当反应达到平衡后,将容器体积压缩为0.5L,一段时间后反应再次达到平衡,则下列说法正确的是CD(填答案选项编号).
A.压缩容器体积,CaC2O4的分解率增大
B.平衡移动后,该反应的化学平衡常数减小
C.平衡移动后,CO和CO2的浓度都没有改变
D.平衡移动后,CaO的质量减少
(2)某温度下数据:Kφ(CaC2O4)=5.0×10-9;Kφ(CaCO3)=2.5×10-9
向0.6mol/L的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:
CO32-(aq)+CaC2O4(s)?CaCO3(s)+C2O42-(aq).静置后沉淀转化达到平衡.求此时溶液中的c(C2O42-)=0.4mol•L-1.
Ⅱ.甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0其他条件相同时,在相同时间内,反应分别在不同催化剂(Ⅰ、Ⅱ、Ⅲ)或不同温度下反应,测得CH4的转化率变化如图所示.
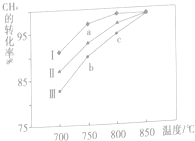
(1)在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ.
(2)a点v正(CH4)大于v逆(CO)(填写“大于”、“小于”或“等于”).
(3)c点CH4的转化率高于b点,原因是b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高.
Ⅲ.工业上用焦炭与水蒸气在高温下制取水煤气,在化工生产中有重要用途.一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:
C(s)+2H2O(g)?CO2(g)+2H2(g).其相关数据如表所示:
(1)温度T2>T1的理由是甲乙两容器中反应物浓度相同,乙达到平衡所有时间短,说明T2温度高.
(2)该反应达到平衡后,升高温度,H2O(g)的转化率变小(填写“变大”、“变小”).
Ⅰ:草酸钙晶体(CaC2O4•H2O)可用作分离稀有金属的载体.
(1)在一定温度下向1L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)?CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为11.2g,则该段时间内v(CO)=0.04mol•L-1•min-1;当反应达到平衡后,将容器体积压缩为0.5L,一段时间后反应再次达到平衡,则下列说法正确的是CD(填答案选项编号).
A.压缩容器体积,CaC2O4的分解率增大
B.平衡移动后,该反应的化学平衡常数减小
C.平衡移动后,CO和CO2的浓度都没有改变
D.平衡移动后,CaO的质量减少
(2)某温度下数据:Kφ(CaC2O4)=5.0×10-9;Kφ(CaCO3)=2.5×10-9
向0.6mol/L的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:
CO32-(aq)+CaC2O4(s)?CaCO3(s)+C2O42-(aq).静置后沉淀转化达到平衡.求此时溶液中的c(C2O42-)=0.4mol•L-1.
Ⅱ.甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0其他条件相同时,在相同时间内,反应分别在不同催化剂(Ⅰ、Ⅱ、Ⅲ)或不同温度下反应,测得CH4的转化率变化如图所示.

(1)在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ.
(2)a点v正(CH4)大于v逆(CO)(填写“大于”、“小于”或“等于”).
(3)c点CH4的转化率高于b点,原因是b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高.
Ⅲ.工业上用焦炭与水蒸气在高温下制取水煤气,在化工生产中有重要用途.一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:
C(s)+2H2O(g)?CO2(g)+2H2(g).其相关数据如表所示:
| 容积 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O | H2 | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
(2)该反应达到平衡后,升高温度,H2O(g)的转化率变小(填写“变大”、“变小”).
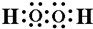 含有的化学键类型有BC(填序号).
含有的化学键类型有BC(填序号). .
.