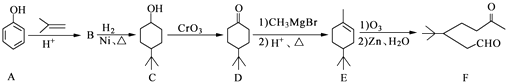
题目内容
【题目】如图所示为元素周期表的一部分,X,Y,W,Z均为短周期元素,其中只有X为金属元素.下列说法错误的是( ) ![]()
A.原子半径:Z<W<Y<X
B.元素Y的氧化物能与NaOH溶液反应
C.最简单气态氢化物的热稳定性:Y<X
D.W,Z的氧化物都能与碱反应生成盐和水
【答案】D
【解析】解:X、Y、W、Z均为短周期元素,其中只有X为金属元素,由元素在周期表中位置,可知X为Al、Y为Si、W为C、Z为N.A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Z<W<Y<X,故A正确;
B.二氧化硅与氢氧化钠反应生成硅酸钠与水,故B正确;
C.Y的氢化物为金属氢化物,属于离子化合物,稳定性比SiH4强,故C正确;
D.CO、NO是不成盐氧化物,不能与碱反应生成盐和水,故D错误,
故选D.

【题目】目前,氯的氧化物有Cl2O、ClO2、Cl2O7等.其中ClO2与Cl2的氧化性质相近,在自来水消毒和果蔬保鲜等方面应用广泛.有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是 .
(2)ClO2是第四代高效、无毒的广谱消毒剂.它可由NaClO2溶液与NCl3溶液反应制得,其反应的离子方程式为NCl3+6ClO ![]() +3H2O═6ClO2+3Cl﹣+3OH﹣+Y,则Y的化学式是 .
+3H2O═6ClO2+3Cl﹣+3OH﹣+Y,则Y的化学式是 .
(3)NaClO2在酸性条件下可发生反应生成NaCl并释放出ClO2 , 该反应的离子方程式是 .
(4)已吸收ClO2的稳定性Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如图所示,若将其用于水果保鲜,你认为效果较好的稳定剂是 , 其原因是 . 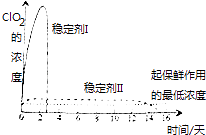
【题目】某酸性FeSO3溶液中含有少量的SnSO4 , 为得到纯净的硫酸亚铁晶体(FeSO4xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至pH=2.过滤后,将所得滤液蒸发浓缩、冷却结晶、过滤洗涤,得到硫酸亚铁晶体.查阅资料,得到相关物质的有关数据如下表:
25℃ | pH | 25℃ | pH |
饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(1)用硫酸亚铁晶体配置FeSO4溶液时还需加入的物质是 .
(2)为检验制得的硫酸亚铁晶体中是否含有Fe3+ , 可选用的试剂为 .
A.KSCN溶液
B.稀硫酸
C.淀粉﹣KI溶液
D.KMnO4溶液
(3)通入H2S气体至饱和的目的是;用硫酸酸化至pH=2的目的是 .
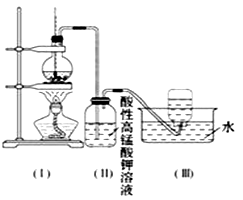
(4)为研究硫酸亚铁晶体的热分解,某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下回分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B的质量测出x的值.
①装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中含有 .
②实验中要持续通入氮气,否则测出的x会(填“偏于”、“偏于”或“不变”).
③硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液.
④某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成的固体质量与分解温度的关系图如图2,根据图中有关数据,可计算出x为 .