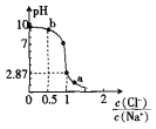
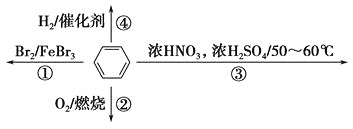
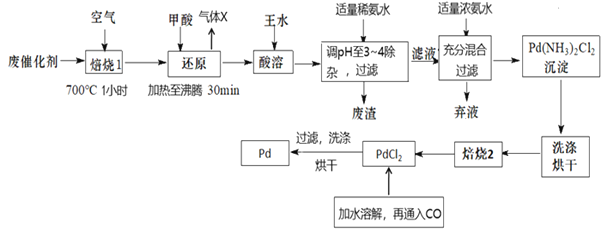
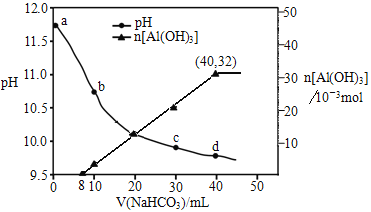
题目内容
【题目】下列条件下,两瓶气体所含原子数一定相等的是
A.同质量、不同密度的N2和COB.同温度、同体积的H2和N2
C.同体积、不同密度的C2H4和C3H6D.同压强、同体积的N2O和CO2
【答案】A
【解析】
A、二者同质量,摩尔质量也相同,根据n=![]() 知,二者分子物质的量相同,也就是分子数相同,这两种分子还都含有2个原子,所以原子数相同,故A正确;
知,二者分子物质的量相同,也就是分子数相同,这两种分子还都含有2个原子,所以原子数相同,故A正确;
B、同温度、同体积,气体分子数目与压强呈正比,压强不定,无法判断气体分子数关系,故B错误;
C、同体积、不同密度的C2H4和C3H6,质量不相等。C2H4和C3H6的最简式相同,质量相等的两种气体含有相同的原子数,但质量不相等,则所含原子数不一定相同,故C错误;
D、同压强、同体积,气体分子数目与温度呈反比,温度不定,无法判断气体分子数关系,故D错误;
故选:A。

【题目】硼是动植物所必须的微量元素,其单质和化合物广泛应用于冶金、机械、化工、核工业、医药、农业等部门。利用硼镁矿(主要成分为Mg2B2O3·5H2O)制取制硼酸、金属镁及粗硼的工艺流程图如下:

已知:①硼砂为Na2B4O7·10H2O
②硼酸(H3BO3)是一种可溶于水的一元弱酸,与过量的NaOH反应生成Na[B(OH)4]
③硼酸在不同温度下的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度(g/100g水) | 3 | 3 | 5 | 7 | 9 | 11 | 15 | 18 | 23 | 29 |
(1)粉碎硼铁矿的目的是:______________;Mg2B2O5·H2O中B的化合价为:______价。
(2)滤渣的主要成分是: ________
(3)硼酸的电子式: ________;写出硼酸在水中电离的方程式: ________________;
(4)X为硼酸晶体加热完全脱水后的产物,其与Mg反应制取粗硼的化学方程式为: ________;
(5)硼砂溶于90℃热水后,常用稀硫酸调pH至2~3(酸性)制取HBO3晶体,该反应的离子方程式为: ________________;从上述溶液中获得H3BO3晶体的操作: ________________。