题目内容
【题目】常温下,向20 mL 0.1mol·L-1NaA溶液中通人HC1气体,溶液的pH随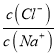 变化的关系如图所示。忽略溶液体积变化,下列有关说法不正确的是
变化的关系如图所示。忽略溶液体积变化,下列有关说法不正确的是
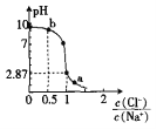
A.水的电离程度:b>a
B.a点溶液中:c(Na+)+c(H+)=c(Cl-)+c(A-)+c(OH-)
C.b点溶液中:c(A-)+2c(H+)=c(HA)+2c(OH-)
D.Ka(HA)的数量级为l0-5
【答案】C
【解析】
根据图像可知,20 mL 0.1mol·L-1NaA溶液呈碱性,此时pH=10,则HA为弱酸;
A. b点由于NaA水解使溶液呈碱性,水解促进水的电离,a点通入的HCl过量,电离使溶液呈酸性,抑制水的电离,则水的电离程度:b>a,A正确;
B. a点溶液根据溶液呈电中性,c(Na+)+c(H+)=c(Cl-)+c(A-)+c(OH-),B正确;
C. b点溶液为NaCl、NaA和HA的溶液,且物质的量相等,根据溶液呈电中性:①c(Na+)+c(H+)=c(Cl-)+c(A-)+c(OH-),A原子守恒:②c(Na+)= c(A-)+ c(HA);③c(Na+)= 2c(Cl-);把②、③代入①,得到c(HA)+2c(H+)= c(A-) +2c(OH-),C错误;
D. 根据图像可知,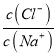 =1时,pH=2.87,此时溶液为NaCl与HA的混合溶液,且物质的量相等,c(H+)= c(A-)=10-2.87,c(HA)接近0.1mol/L,Ka(HA)的数量级为l0-5,D正确;
=1时,pH=2.87,此时溶液为NaCl与HA的混合溶液,且物质的量相等,c(H+)= c(A-)=10-2.87,c(HA)接近0.1mol/L,Ka(HA)的数量级为l0-5,D正确;
答案为D

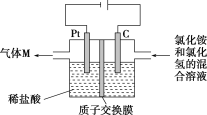
【题目】锰锌铁氧体是应用广泛的高性能磁性材料。现以akg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如下:
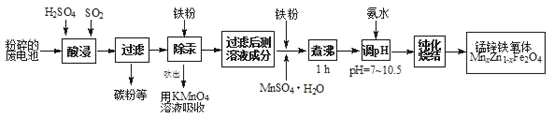
(1)酸浸废电池时,被溶解生成Zn2+的物质有______,SO2的作用是_____(填字母编号)。
A.漂白剂 | B.沉淀剂 | C.氧化剂 | D.还原剂 |
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。
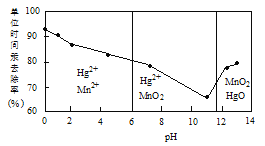
①pH<6时反应的离子方程式为___________。
②汞的去除速率随pH变化的规律是_________。
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)=2MnO2(s) H=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是_______________。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为____________。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O)_________kg。(只列出计算式)