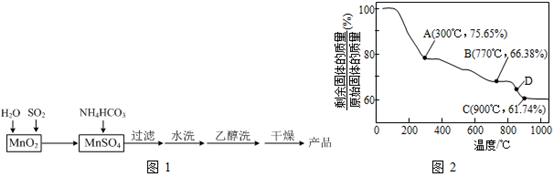
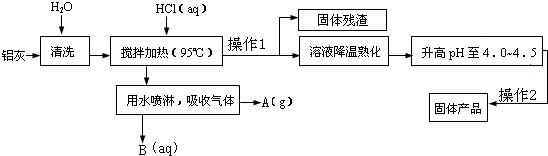
��Ŀ����
��ѧѧϰС���ijþ���Ͻ����������ʵ���о���������벢��ɶ��й�����Ľ��
ʵ��ҩƷ��9.0gþ���Ͻ�100mLamol/Lϡ���ᣬ260mL5mol/L����������Һ��
ʵ�鲽��

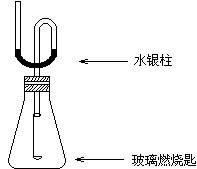
�ٽ�9.0gþ���Ͻ���100mLamol/Lϡ������ͼ��ʾװ���г�ַ�Ӧ����Ӧ��ϣ����ռ����ɵ�ȫ�����壮
����b�ڵĻ��Һ����μ���260mL5mol/L����������Һ����ֻ�ϣ�������������Һ�μ���200mLʱ���ɵij��������
��������
��1������b��������______��
��2������ʵ��Ŀ�Ŀ�֪��9.0gþ���Ͻ���100amol/Lϡ���ᷴӦʱ��Ӧ�ù����㣩����������______���þ���Ͻ𡱻�ϡ���ᡱ�����Ա�֤��һ�������ܹ���ȫ��Ӧ��ʣ�࣮
��3��ʵ�鲽����У���b�ڻ��Һ����μ�����������Һ�����ɵij��������ʱ����ʱ������Һ�е�������______��
��4��ʵ�鲽��ٽ�����ȡ��Ͳ�����ֵ�����ʱ����Ҫע���������Ҫ�����ǣ�һ��Ҫ______������Ҫ������ͲҺ������ƿҺ����ƽ������Ҫʹ��������Ͳ�ڵİ�Һ����ƽ��
��5������״���£���ʵ�鲽��ٵõ����������Ϊ10.08L����Ͻ���þ����������Ϊ______��
��6���ڡ�amol/Lϡ���ᡱ��a��ֵΪ______��
��7������ͼ�л���ʵ�鲽��������ɳ��������ʵ�����n�����������������Һ�����[v��NaOH��]�ı仯���ߣ�
ʵ��ҩƷ��9.0gþ���Ͻ�100mLamol/Lϡ���ᣬ260mL5mol/L����������Һ��
ʵ�鲽��

�ٽ�9.0gþ���Ͻ���100mLamol/Lϡ������ͼ��ʾװ���г�ַ�Ӧ����Ӧ��ϣ����ռ����ɵ�ȫ�����壮
����b�ڵĻ��Һ����μ���260mL5mol/L����������Һ����ֻ�ϣ�������������Һ�μ���200mLʱ���ɵij��������
��������
��1������b��������______��
��2������ʵ��Ŀ�Ŀ�֪��9.0gþ���Ͻ���100amol/Lϡ���ᷴӦʱ��Ӧ�ù����㣩����������______���þ���Ͻ𡱻�ϡ���ᡱ�����Ա�֤��һ�������ܹ���ȫ��Ӧ��ʣ�࣮
��3��ʵ�鲽����У���b�ڻ��Һ����μ�����������Һ�����ɵij��������ʱ����ʱ������Һ�е�������______��
��4��ʵ�鲽��ٽ�����ȡ��Ͳ�����ֵ�����ʱ����Ҫע���������Ҫ�����ǣ�һ��Ҫ______������Ҫ������ͲҺ������ƿҺ����ƽ������Ҫʹ��������Ͳ�ڵİ�Һ����ƽ��
��5������״���£���ʵ�鲽��ٵõ����������Ϊ10.08L����Ͻ���þ����������Ϊ______��
��6���ڡ�amol/Lϡ���ᡱ��a��ֵΪ______��
��7������ͼ�л���ʵ�鲽��������ɳ��������ʵ�����n�����������������Һ�����[v��NaOH��]�ı仯���ߣ�
��1��ʵ��װ������������ͺϽ�Ӧ��������ԭ����ƿ���ʴ�Ϊ��Բ����ƿ��
��2������ʵ��Ŀ�Ŀ�֪�ⶨ�Ͻ���þ��������������ʵ��ʽ��Ҫ�Ͻ�ȫ����Ӧ��������Ҫϡ����������ʴ�Ϊ��ϡ���
��3��ʵ�鲽����У���b�ڻ��Һ����μ�����������Һ�����ɵij��������ʱ�����ķ�ӦΪ��Mg+H2SO4=MgSO4+H2����2Al+3H2SO4=Al2��SO4��3+3H2����Mg2++2OH-=Mg��OH��2����Al3++3OH-=Al��OH��3����������Ӧ�õ�����������ⶨ�������ΪNa2SO4���ʴ�Ϊ��Na2SO4��
��4����ˮ��������Ҫע��ˮҪ��ȴ�����£�������ͲҺ������ƿҺ����ƽ��ʹ��������Ͳ�ڵİ�Һ����ƽ���ʴ�Ϊ����ȴ�����£�
��5������״���£���ʵ�鲽��ٵõ����������Ϊ10.08L�����ݷ�Ӧ���㣺��þ���ʵ���ΪX�������ʵ���ΪY�������������ʵ���=
=0.45mol��
Mg+H2SO4=MgSO4+H2����2Al+3H2SO4=Al2��SO4��3+3H2����
X X Y 1.5Y
X+1.5Y=0.45
24X+27Y=9
�ⷽ�̵õ���X=0.15mol��Y=0.2mol��
��þ����������=
��100%=0.4��
�ʴ�Ϊ��0.4��
��6��f��Ӧ�������������������ʱ�����ݻ�ѧ����ʽ�����жϣ��൱���������������ȫ����Ӧ�����������Ӻ��������������ʵ�����ͬ��ʽ��
100mLamol/Lϡ�����200mL5mol/L����������Һǡ�÷�Ӧ��0.1��a=0.2��5��a=5���ʴ�Ϊ��5��
��7���������ʵ���=0.1L��5mol/L=05mol��Mg+H2SO4=MgSO4+H2����2Al+3H2SO4=Al2��SO4��3+3H2����������������õ�ʣ������=0.5mol-0.15mol-0.3mol=0.05mol�����������������=
=0.02L=20ml������������ⶨ��Ҫ�����������ʵ���=0.15mol��2+0.2mol��3=0.9mol����������������Һ���=
=0.18l=180ml��������������ȫ���ܽⷢ����Ӧ��Al��OH0��3+OH-=AlO2-+2H2O����Ҫ�����������ʵ���Ϊ0.2mol�����Ϊ40ml������������������Һ���=20ml+180ml+40ml=240mol�����ݳ��������Ϊ0.35mol��������þ����Ϊ0.15mol�����ͼ������㻭��ͼ��Ϊ
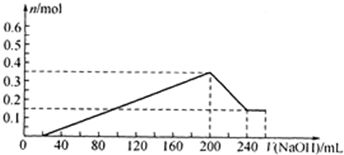 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2������ʵ��Ŀ�Ŀ�֪�ⶨ�Ͻ���þ��������������ʵ��ʽ��Ҫ�Ͻ�ȫ����Ӧ��������Ҫϡ����������ʴ�Ϊ��ϡ���
��3��ʵ�鲽����У���b�ڻ��Һ����μ�����������Һ�����ɵij��������ʱ�����ķ�ӦΪ��Mg+H2SO4=MgSO4+H2����2Al+3H2SO4=Al2��SO4��3+3H2����Mg2++2OH-=Mg��OH��2����Al3++3OH-=Al��OH��3����������Ӧ�õ�����������ⶨ�������ΪNa2SO4���ʴ�Ϊ��Na2SO4��
��4����ˮ��������Ҫע��ˮҪ��ȴ�����£�������ͲҺ������ƿҺ����ƽ��ʹ��������Ͳ�ڵİ�Һ����ƽ���ʴ�Ϊ����ȴ�����£�
��5������״���£���ʵ�鲽��ٵõ����������Ϊ10.08L�����ݷ�Ӧ���㣺��þ���ʵ���ΪX�������ʵ���ΪY�������������ʵ���=
| 10.08L |
| 22.4L/mol |
Mg+H2SO4=MgSO4+H2����2Al+3H2SO4=Al2��SO4��3+3H2����
X X Y 1.5Y
X+1.5Y=0.45
24X+27Y=9
�ⷽ�̵õ���X=0.15mol��Y=0.2mol��
��þ����������=
| 0.15mol��24g/mol |
| 9.0g |
�ʴ�Ϊ��0.4��
��6��f��Ӧ�������������������ʱ�����ݻ�ѧ����ʽ�����жϣ��൱���������������ȫ����Ӧ�����������Ӻ��������������ʵ�����ͬ��ʽ��
100mLamol/Lϡ�����200mL5mol/L����������Һǡ�÷�Ӧ��0.1��a=0.2��5��a=5���ʴ�Ϊ��5��
��7���������ʵ���=0.1L��5mol/L=05mol��Mg+H2SO4=MgSO4+H2����2Al+3H2SO4=Al2��SO4��3+3H2����������������õ�ʣ������=0.5mol-0.15mol-0.3mol=0.05mol�����������������=
| 0.05mol��2 |
| 5mol/L |
| 0.9mol |
| 5mol/L |
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��ϰ��ϵ�д�
�����Ŀ