题目内容
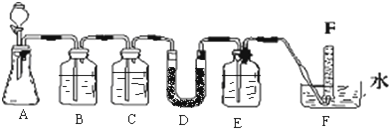
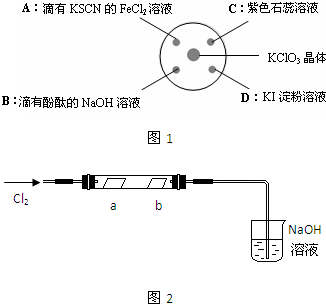
为探究氯气的性质,某同学做了如图1所示的实验,将少量试剂分别放入培养皿中的相应位置,已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.请回答下列问题:
(1)用单线桥表示生成氯气的反应电子转移的方向和数目:______
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(2)实验A的现象是______,反应的离子方程式为______.
(3)实验D的现象是______,反应的离子方程式为______,
这一实验说明氧化性Cl2______I2(填“>”或“<”).
(4)实验C的现象是紫色石蕊溶液先变红,后褪色,使石蕊试液变红的反应的离子方程式为______.为了探究褪色原因,这位同学又做了如图2所示实验,将干燥的氯气通入双通管中,其中a为干燥的红纸条,b为湿润的红纸条.
①实验现象是:a______,b______.NaOH溶液的作用______.
②该实验说明具有漂白作用的物质是______.
③将氯气通入水中形成黄绿色的氯水,见光放置数天后黄绿色会褪去,同时失去漂白作用,原因是______(用化学方程式表示).
(5)实验B的实验现象是______,工业上利用与实验B类似的反应制备漂白粉,制漂白粉的化方程式为______.

(1)用单线桥表示生成氯气的反应电子转移的方向和数目:______
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(2)实验A的现象是______,反应的离子方程式为______.
(3)实验D的现象是______,反应的离子方程式为______,
这一实验说明氧化性Cl2______I2(填“>”或“<”).
(4)实验C的现象是紫色石蕊溶液先变红,后褪色,使石蕊试液变红的反应的离子方程式为______.为了探究褪色原因,这位同学又做了如图2所示实验,将干燥的氯气通入双通管中,其中a为干燥的红纸条,b为湿润的红纸条.
①实验现象是:a______,b______.NaOH溶液的作用______.
②该实验说明具有漂白作用的物质是______.
③将氯气通入水中形成黄绿色的氯水,见光放置数天后黄绿色会褪去,同时失去漂白作用,原因是______(用化学方程式表示).
(5)实验B的实验现象是______,工业上利用与实验B类似的反应制备漂白粉,制漂白粉的化方程式为______.
(1)反应中KClO3为氧化剂,得电子,HCl为还原剂,失电子,由化合价的变化可知转移电子方向和数目可表示为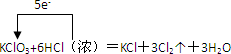 ,
,
故答案为: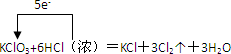 ;
;
(2)氯气氧化Fe2+生成Fe3+,溶液变红,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:浅绿色溶液变为红色溶液;2Fe2++Cl2=2Fe3++2Cl-;
(3)氯气氧化KI生成碘,试纸变成蓝色,反应的方程式为2I-+Cl2=I2+2Cl-,氧化剂氧化性大于氧化产物氧化性,则氧化性Cl2较强,
故答案为:无色溶液变为蓝色;2I-+Cl2=I2+2Cl-;>;
(4)实验C的现象是紫色石蕊溶液先变红,后褪色,使石蕊试液变红的反应的离子方程式为Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
①干燥的氯气不具有漂白性,氯气与水反应,生成具有漂白性的HClO,则b褪色,由于氯气有毒不能排放到空气中,应用NaOH溶液吸收,
故答案为:不褪色;褪色;吸收Cl2,防止污染空气.
②a和b向比较,b中含有HClO,具有漂白性,故答案为:HClO.
③将氯气通入水中形成黄绿色的氯水,见光放置数天后黄绿色会褪去,同时失去漂白作用,原因是次氯酸不稳定,见光易分解,反应的方程式为2HClO
2HCl+O2↑,
故答案为:2HClO
2HCl+O2↑;
(5)氯气和氢氧化钠反应,可观察到红色溶液褪色,与氢氧化钙反应生成氯化钙和次氯酸钙,反应的方程式为2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,
故答案为:红色溶液褪色;2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O.
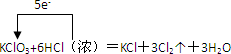 ,
,故答案为:
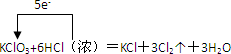 ;
;(2)氯气氧化Fe2+生成Fe3+,溶液变红,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:浅绿色溶液变为红色溶液;2Fe2++Cl2=2Fe3++2Cl-;
(3)氯气氧化KI生成碘,试纸变成蓝色,反应的方程式为2I-+Cl2=I2+2Cl-,氧化剂氧化性大于氧化产物氧化性,则氧化性Cl2较强,
故答案为:无色溶液变为蓝色;2I-+Cl2=I2+2Cl-;>;
(4)实验C的现象是紫色石蕊溶液先变红,后褪色,使石蕊试液变红的反应的离子方程式为Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
①干燥的氯气不具有漂白性,氯气与水反应,生成具有漂白性的HClO,则b褪色,由于氯气有毒不能排放到空气中,应用NaOH溶液吸收,
故答案为:不褪色;褪色;吸收Cl2,防止污染空气.
②a和b向比较,b中含有HClO,具有漂白性,故答案为:HClO.
③将氯气通入水中形成黄绿色的氯水,见光放置数天后黄绿色会褪去,同时失去漂白作用,原因是次氯酸不稳定,见光易分解,反应的方程式为2HClO
| ||
故答案为:2HClO
| ||
(5)氯气和氢氧化钠反应,可观察到红色溶液褪色,与氢氧化钙反应生成氯化钙和次氯酸钙,反应的方程式为2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,
故答案为:红色溶液褪色;2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
 测定剩余固体质量
测定剩余固体质量