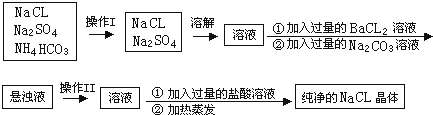
题目内容
【题目】氯化铜在工农业生产中具有重要的用途。某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。已知:SOCl2的熔点为-105℃,沸点为76℃,遇水剧烈水解生成两种酸性气体。回答下列问题:
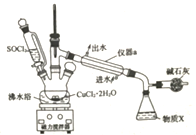
(1)在空气中直接加热CuCl2·2H2O晶体得不到纯净的无水CuCl2的原因是___________________(用化学方程式表示)。
(2)仪器a的名称是____________,锥形瓶中得到的物质x的化学式为______________。
(3)碱石灰中含有CaO和NaOH,NaOH的电子式为__________,碱石灰的作用是______________。
(4)三颈烧瓶中CuCl2·2H2O和SOCl2发生反应的化学方程式是_______________________。
(5)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取 0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL(滴定反应为I2+2S2O32-=S4O42-+2I-)。
①滴定到终点时的现象是_____________________________________。
②该试样中铜元素的百分含量为__________ 。
【答案】 CuCl2·2H2O![]() Cu(OH)2+2HCl↑ 冷凝管 SOCl2 Na+[∶
Cu(OH)2+2HCl↑ 冷凝管 SOCl2 Na+[∶![]() ∶H]- 防止空气中水蒸气进入锥形瓶,同时吸收SO2、HCl等有害气体 CuCl2·2H2O+2SOCl2
∶H]- 防止空气中水蒸气进入锥形瓶,同时吸收SO2、HCl等有害气体 CuCl2·2H2O+2SOCl2![]() CuCl2+2SO2↑+4HCl↑ 滴入最后一滴Na2S2O3标准溶液时,溶液由蓝色变为无色,且半分钟内不恢复为蓝色 45.71%
CuCl2+2SO2↑+4HCl↑ 滴入最后一滴Na2S2O3标准溶液时,溶液由蓝色变为无色,且半分钟内不恢复为蓝色 45.71%
【解析】(1)由于氯化铜水解,加热促进水解,因此在空气中直接加热CuCl2·2H2O晶体得不到纯净的无水CuCl2,反应的化学方程式为CuCl2·2H2O![]() Cu(OH)2+2HCl↑。(2)根据仪器构造可知仪器a的名称是冷凝管。由于SOCl2的熔点为-105℃,沸点为76℃,所以锥形瓶中得到的物质x的化学式为SOCl2。(3)氢氧化钠是离子化合物,电子式为
Cu(OH)2+2HCl↑。(2)根据仪器构造可知仪器a的名称是冷凝管。由于SOCl2的熔点为-105℃,沸点为76℃,所以锥形瓶中得到的物质x的化学式为SOCl2。(3)氢氧化钠是离子化合物,电子式为![]() ;SOCl2遇水剧烈水解生成两种酸性气体,气体是SO2和HCl,另外氯化铜易水解,所以碱石灰的作用是防止空气中水蒸气进入锥形瓶,同时吸收SO2、HCl等有害气体。(4)根据以上分析可知三颈烧瓶中CuCl2·2H2O和SOCl2发生反应的化学方程式是 CuCl2·2H2O+2SOCl2
;SOCl2遇水剧烈水解生成两种酸性气体,气体是SO2和HCl,另外氯化铜易水解,所以碱石灰的作用是防止空气中水蒸气进入锥形瓶,同时吸收SO2、HCl等有害气体。(4)根据以上分析可知三颈烧瓶中CuCl2·2H2O和SOCl2发生反应的化学方程式是 CuCl2·2H2O+2SOCl2![]() CuCl2+2SO2↑+4HCl↑。(5)①由于碘遇淀粉显蓝色,所以滴定到终点时的现象是滴入最后一滴Na2S2O3标准溶液时,溶液由蓝色变为无色,且半分钟内不恢复为蓝色。②根据方程式2Cu2++4I-=2CuI↓+I2、I2+2S2O32-=S4O42-+2I-可知2Cu2+~I2~2S2O32-,则铜离子的物质的量是0.1000mol/L×0.0200L=0.00200mol,所以该试样中铜元素的百分含量为
CuCl2+2SO2↑+4HCl↑。(5)①由于碘遇淀粉显蓝色,所以滴定到终点时的现象是滴入最后一滴Na2S2O3标准溶液时,溶液由蓝色变为无色,且半分钟内不恢复为蓝色。②根据方程式2Cu2++4I-=2CuI↓+I2、I2+2S2O32-=S4O42-+2I-可知2Cu2+~I2~2S2O32-,则铜离子的物质的量是0.1000mol/L×0.0200L=0.00200mol,所以该试样中铜元素的百分含量为![]() ×100%=45.71%。
×100%=45.71%。

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
【题目】除去下列物质中的杂质,所用试剂和方法正确的是
选项 | 物质 | 杂质 | 除杂质所用试剂和方法 |
A | KCl溶液 | I2 | 加热,升华 |
B | KNO3 | K2SO4 | BaCl2溶液,过滤 |
C | Cu | CuO | 稀硫酸,过滤 |
D | CaCO3 | CaO | 盐酸,过滤 |
A. A B. B C. C D. D