��Ŀ����
����Ŀ��CH4��NH3��H2O��H2S��NH4NO3��ZnS����ѧ��ѧ���������ֻ�����ش��������⣺
��1����̬Sԭ����__________�ֲ�ͬ�����ĵ��ӣ���Znͬ��ds����ͬ���ڵ�Ԫ�ػ�̬ԭ�Ӻ�������Ų�ʽΪ____________________��
��2��H2O��H2S�У��е�ϸߵ���__________��ԭ����___________________________________��
��3��CH4��NH3��H2O3���⻯���У������ɴ�С��˳��Ϊ_______________������NH3��VESEPRģ������Ϊ____________��
��4��NO3-���ӵļ��ι���Ϊ__________��NO3-���ӵĵ�������_____________����дһ�֣���
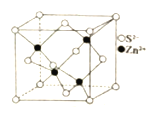
��5��ZnS����ṹ�ж��֣�����һ�־���ľ����ṹ��ͼ��ʾ����������S2-�Ⱦ����������S2-��_____������֪�þ���ľ�������Ϊanm�����ܶ�Ϊ ��g��cm-3�����ӵ���������ֵΪ____________________________���ú���ĸa�����ı���ʽ��ʾ���г�����ʽ���ɣ���
���𰸡� 5 [Ar]3d104s1����1s22s22p63s23p63d104s1�� H2O H2O���Ӽ����γ���� CH4��NH3��H2O �������������������� ƽ�������� CO32-��SiO32-��SO3��BF3�� 12 ![]()
����������1��S�ĺ����������16����������Ų�ʽΪ1s22s22p63s23p4�����Ի�̬Sԭ����5�ֲ�ͬ�����ĵ�������Znͬ��ds����ͬ���ڵ�Ԫ����ͭ��ͭ��ԭ��������29�����ݺ�������Ų����ɿ�֪���̬ԭ�Ӻ�������Ų�ʽΪ [Ar]3d104s1����2������H2O���Ӽ����γ���������Էе�ϸߵ���H2O����3��CH4��NH3��H2O�������ʵĿռ乹�ͷֱ����������塢�����κ�V�Σ�������ɴ�С��˳��ΪCH4��NH3��H2O�����ڰ��������е�ԭ�Ӻ���һ�Թ¶Ե�������NH3��VESEPRģ������Ϊ�������Ρ���4��NO3������������ԭ�ӵļ۲���Ӷ�����3+(5+1-3��2)/2��3�������ڹ¶Ե��ӣ�����������ļ��ι���Ϊƽ�������Σ�ԭ�����ͼ۵������ֱ���ȵĻ�Ϊ�ȵ����壬����NO3�����ӻ�Ϊ�ȵ�������CO32����SiO32����SO3��BF3�ȡ���5��������п�ľ����ṹ��֪��������S2���Ⱦ����������S2��λ�����Ĵ���������12���������������Ӹ�����8��1/8+6��1/2��4��п����ȫ���ھ����У�Ҳ��4������֪�þ���ľ�������Ϊanm�����ܶ�Ϊ ��g��cm��3����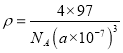 �����
�����![]() ��
��
