题目内容
10.X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如表所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的是( )| X | Y | ||
| Z | W |
| A. | 金属性由强到弱的顺序为:Z、W | |
| B. | 原子半径由大到小的顺序为:Y、Z | |
| C. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y | |
| D. | 工业上常用电解熔融Z的氧化物得到单质Z |
分析 由X、Y、Z、W为四种短周期主族元素在周期表中的相对位置可知,Z为第三周期元素,Z元素原子核外K层与M层电子数相等,则M层电子数为2,可知Z为Mg,结合元素在周期表的位置可知,W为Al,X为C,Y为N,以此来解答.
解答 解:由上述分析可知,X为C,Y为N,Z为Mg,W为Al,
A.同周期从左向右金属性减弱,则金属性由强到弱的顺序为:Z、W,故A正确;
B.电子层越多,原子半径越大,则原子半径由大到小的顺序为:Z、Y,故B错误;
C.非金属性越强,对应氢化物越稳定,则气态氢化物的稳定性由强到弱的顺序:Y、X,故C错误;
D.MgO的熔点高,应电解熔融氯化镁来冶炼单质Mg,故D错误;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
20.下列化学用语正确的是( )
| A. | 2-乙基-1,3-丁二烯分子的键线式: | B. | 丙烷分子的比例模型: | ||
| C. | 甲醛的电子式: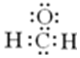 | D. | 聚丙烯的结构简式: |
18.分子式为C3H6Cl2的有机物,发生一元氯代反应后,可以生成三种同分异构体,则原C3H6Cl2的名称是( )
| A. | 1,2-二氯丙烷 | B. | 1,1-二氯丙烷 | C. | 1,3-二氯丙烷 | D. | 2,2-二氯丙烷 |
5.利用铝热反应原理焊接钢轨的化学方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,关于该反应的叙述错误的是( )
| A. | 属于置换反应 | B. | A1作还原剂 | ||
| C. | Fe2O3被还原 | D. | 该反应是吸热反应 |
15.下列化合物中既有离子键又有共价键的是( )
| A. | SiO2 | B. | CO2 | C. | NaBr | D. | NH4Cl |
2.金属钒及其化合物有着广泛的应用,现有如下回收利用含钒催化剂[含有V2O5、VOSO4(强电解质)及不溶性残渣]的工艺的主要流程:

部分含钒物质在水中的溶解性如表所示:
请回答下列问题:
(1)工业上常用铝热反应由V2O5冶炼金属钒,化学方程式为3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)反应①、②、③、④中,发生氧化还原反应的是①②(填序号),写出反应①的离子方程式V2O5+SO32-+4H+=2VO2++SO42-+2H2O.操作1、操作2用到的玻璃仪器是烧杯、玻璃棒、漏斗.
(3)反应③的沉淀率(又称沉钒率)是回收钒的关键之一,图2是反应温度与沉钒率的关系图,则控制温度的方法是将反应容器置于80℃的水浴中.

(4)反应④在焙烧过程中随温度的升高发生了两步反应.已知234gNH4VO3固体质量的减少值△W随温度(T)变化的曲线如图3.试写出300℃~350℃时反应的化学方程式2HVO3 $\frac{\underline{\;300°C-350°C\;}}{\;}$V2O5+H2O.
(5)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+.电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.

部分含钒物质在水中的溶解性如表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 | HVO3 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 | 难溶 |
(1)工业上常用铝热反应由V2O5冶炼金属钒,化学方程式为3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)反应①、②、③、④中,发生氧化还原反应的是①②(填序号),写出反应①的离子方程式V2O5+SO32-+4H+=2VO2++SO42-+2H2O.操作1、操作2用到的玻璃仪器是烧杯、玻璃棒、漏斗.
(3)反应③的沉淀率(又称沉钒率)是回收钒的关键之一,图2是反应温度与沉钒率的关系图,则控制温度的方法是将反应容器置于80℃的水浴中.

(4)反应④在焙烧过程中随温度的升高发生了两步反应.已知234gNH4VO3固体质量的减少值△W随温度(T)变化的曲线如图3.试写出300℃~350℃时反应的化学方程式2HVO3 $\frac{\underline{\;300°C-350°C\;}}{\;}$V2O5+H2O.
(5)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+.电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.
20.氮氧化铝(AlON)是一种高硬度防弹材料,可以在高温下由反应Al2O3+C+N2═2AlON+CO合成,下列有关说法合理的是( )
| A. | 上述反应中氮气作还原剂 | |
| B. | 氮氧化铝中氮元素的化合价是-3 | |
| C. | 氮氧化铝晶体中的作用力是范德华力 | |
| D. | 根据氮氧化铝晶体的硬度可推断其晶体类型可能与石英相同 |

 实验室需要配制1.00mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制1.00mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.