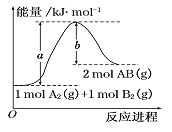
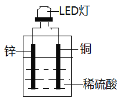
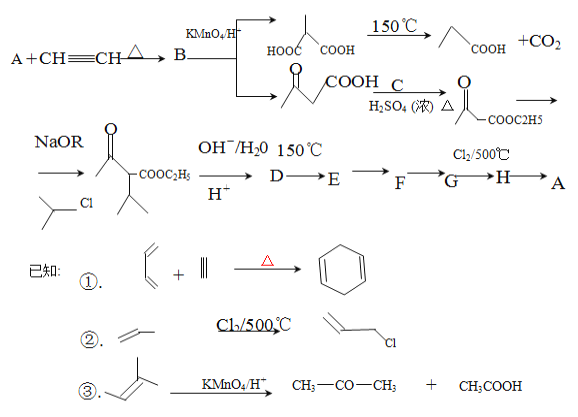
题目内容
【题目】配平化学反应方程式并标出电子转移的方向和总数:
____Fe(NO3)3 + ____NaOH + ___Cl2 → ___Na2FeO4 + ____NaNO3 + ___NaCl + ____H2O,___________
(1)上述反应中______元素被氧化,发生还原反应的物质是_________
(2)写出铁元素在元素周期表中的位置是第______周期第____________族
(3)写出上述反应中还原产物的电子式___________________
(4)若反应中转移了0.1 mol电子,则消耗了_______L Cl2(标准状况)。
【答案】 ![]() +3价的铁 Cl2 四 VIII
+3价的铁 Cl2 四 VIII ![]() 1.12
1.12
【解析】用化合价升降法配平。在该反应中Fe元素的化合价由Fe(NO3)3中的+3价升至Na2FeO4中的+6价,1molFe(NO3)3参与反应失去3mol电子生成1molNa2FeO4;Cl元素的化合价由0价降至NaCl中的-1价,1molCl2参与反应得到2mol电子生成2molNaCl;根据得失电子守恒、原子守恒配平方程式。对比氧化还原反应的概念作答。
在该反应中Fe元素的化合价由Fe(NO3)3中的+3价升至Na2FeO4中的+6价,1molFe(NO3)3参与反应失去3mol电子生成1molNa2FeO4;Cl元素的化合价由0价降至NaCl中的-1价,1molCl2参与反应得到2mol电子生成2molNaCl;根据得失电子守恒、原子守恒,配平后的方程式为2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4+6NaNO3+6NaCl+8H2O。电子转移方向和数目为:![]() 。
。
(1)上述反应中Fe元素化合价升高,+3价的Fe元素被氧化。Cl元素的化合价降低,发生还原反应的物质是Cl2。
(2)Fe的原子结构示意图为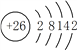 ,铁元素在元素周期表中的位置是第4周期第VIII族。
,铁元素在元素周期表中的位置是第4周期第VIII族。
(3)上述反应中还原产物为NaCl,NaCl的电子式为![]() 。
。
(4)根据上述分析每消耗1molCl2转移2mol电子,若反应中转移了0.1mol电子,消耗Cl2物质的量为0.05mol,消耗Cl2在标准状况下的体积为0.05mol![]() 22.4L/mol=1.12L。
22.4L/mol=1.12L。

【题目】下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
4 | ⑧ | ⑨ | ⑩ |
(1)写出下列元素的元素符号:① _____ ②_____ ⑩_____
(2)在这些元素中,最活泼的金属元素是_____,最不活泼的元素是_____。
(3)这些元素的最高价氧化物对应水化物中,具有两性的是__________,它在水中的电离方程式为______________________________________________/span>
(4)将元素⑤、⑨和⑩的简单离子按半径由大到小排序____________________
(5)在③与④的单质中,化学性质较活泼的是____,写出一个可以验证该结论的化学事实______________________________________________________________
【题目】下列实验操作或事实与预期实验目的或所得结论对应正确的是( )
选项 | 实验操作或事实 | 实验目的或结论 |
A | 淡黄色试液 | 说明原溶液中一定含所有FeCl3 |
B | CaO | 用生石灰制备NaOH溶液 |
C | 新收集的酸雨 | 酸雨中一定含有SO42- |
D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于三元酸 |
A. A B. B C. C D. D