题目内容
【题目】下表列出了元素周期表中前20号元素中某些元素性质的一些数据:
性质元素 | 原子半径( | 最高价态 | 最低价态 |
① | 1.02 |
|
|
② | 2.27 |
| — |
③ | 0.74 | — |
|
④ | 1.43 |
| — |
⑤ | 0.77 |
|
|
⑥ | 1.10 |
|
|
⑦ | 0.99 |
|
|
⑧ | 1.86 |
| — |
⑨ | 0.75 |
|
|
⑩ | 1.17 |
|
|
试回答下列问题。
(1)以上10种元素中,第一电离能最小的是______(填序号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质有______(填分子式,两种即可)。元素⑨和⑩形成的化合物的化学式为______;元素①的原子价电子排布式是______。
(3)①、⑥、⑦、⑩四种元素的简单氢化物的稳定性由强到弱的顺序是______(填化学式)。
(4)③和⑨两元素相比,非金属性较弱的是______(填名称),可以验证该结论的是______(填序号)。
A.气态氢化物的挥发性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.最简单氢化物的稳定性
F.两单质在自然界中的存在形式
【答案】② ![]()
![]()
![]()
![]()
![]() 氮元素 CE
氮元素 CE
【解析】
前20号元素中,①③都为最低价-2,处于VIA族,①有+6价,③只有-2价,则①为S、③为O;⑤⑩都有+4、-4价,处于IVA族,⑤的原子半径较小,则⑤是C、⑩是Si;⑥⑨都有+5、-3价,处于VA族,⑥的原子半径大于⑨,则⑥是P、⑨是N;⑦有+7、-1价,为ⅦA族元素,⑦是Cl元素;④只有+3价,为ⅢA族元素,原子半径大于Si原子半径,所以④是Al元素;②⑧最高正价为+1,没有负价,处于IA族,②的原子半径比Al原子半径大很多,不能处于同周期,则②为K,②⑧原子半径相差不是太大,应相邻,则⑧为Na;据此解答。
根据上述分析可知,
(1)在同一周期中,从第ⅠA族到第ⅦA族,元素的第一电离能呈增大趋势;同一主族中,从上向下,元素的第一电离能逐渐减小,故在10种元素中,第一电离能最小的是②;
(2)C、P、Cl三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质可能是PCl3或CCl4。元素N和Si形成的化合物的化学式为Si3N4;元素S的原子价电子排布式是3s23p4;
(3)元素的非金属性越强,形成气态氢化物越稳定,非金属性强弱为Cl>S>P>Si,故其氢化物稳定性为HCl>H2S>PH3>SiH4;
(4)③是O元素、⑨是N元素,为同周期元素,从左到右元素的非金属性逐渐增强,则非金属性较弱的是氮元素;A.分子间作用力影响气态氢化物的物理性质,不能说明元素非金属性强弱,故A错误;B.单质分子成键不同,键能不能说明元素非金属性强弱,故B错误;C.电负性越大,对键合电子吸引力越大,元素非金属性越强,故C正确;D.氧元素没有含氧酸,不能比较最高价含氧酸的酸性判断非金属性强弱,故D错误;E.氢化物中,键长越长,键能越小,氢化物越不稳定,元素的非金属性越弱,故E正确;F.两单质在自然界的存在形式不能比较元素的非金属性强弱,故F错误,故选CE。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
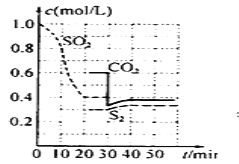
小学生10分钟应用题系列答案【题目】如图是CO2生产甲醇的能量变化示意图.下列说法正确的是( )

A.E2_E1是该反应的热效应
B.E3_E1是该反应的热效应
C.该反应放热,在常温常压下就能进行
D.实现变废为宝,且有效控制温室效应
【题目】有五种短周期元素,它们的结构、性质等信息如下表所示:
元素 | 结构、性质等信息 |
A | 是短周期元素(稀有气体元素除外)中原子半径最大的元素,含该元素的某种合金是原子反应堆的导热剂 |
B | 与A同周期,其最高价氧化物对应的水化物呈两性 |
C | 其气态氢化物极易溶于水,液态时常用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的杀菌消毒剂 |
E | 元素原子的 |
请根据表中信息回答下列问题。
(1)![]() 元素原子的核外电子排布式为______。
元素原子的核外电子排布式为______。
(2)![]() 元素在元素周期表中的位置为______;离子半径:
元素在元素周期表中的位置为______;离子半径:![]() ______(填“
______(填“![]() ”或“
”或“![]() ”)
”)![]() 。
。
(3)![]() 元素原子的电子排布图为其原子核外有______个未成对电子,能量最高的电子排布在______轨道上,该轨道呈______。
元素原子的电子排布图为其原子核外有______个未成对电子,能量最高的电子排布在______轨道上,该轨道呈______。
(4)![]() 元素原子的核外电子排布式为______,
元素原子的核外电子排布式为______,![]() 的结构示意图为______。
的结构示意图为______。
(5)![]() 、
、![]() 元素的第一电离能的大小关系是______(用元素符号表示)。
元素的第一电离能的大小关系是______(用元素符号表示)。
(6)已知![]() 分子中
分子中![]() 元素显
元素显![]() 价,则该情况下,
价,则该情况下,![]() 、
、![]() 元素的电负性大小关系是______(用元素符号表示),
元素的电负性大小关系是______(用元素符号表示),![]() 与水反应后的产物是______(填化学式)。
与水反应后的产物是______(填化学式)。