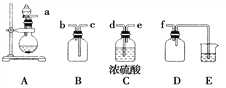
题目内容
【题目】以CO和H2为原料生产二甲醚(CH3OCH3)主要发生以下三个反应

(1)该工艺的总反应为3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g)△H
CH3OCH3(g)+CO2(g)△H
该反应△H=_______________,化学平衡常数K=__________(用含K1、K2、K3的代数式表示)。
(2)某温度下,将8.0molH2和4 molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),5分钟后反应达平衡,测得二甲醚的体积分数为1/6,则用CH3OCH3的浓度变化表示该反应的速率为__________mol·L—1min—1,CO的转化率为_________。
CH3OCH3(g)+H2O(g),5分钟后反应达平衡,测得二甲醚的体积分数为1/6,则用CH3OCH3的浓度变化表示该反应的速率为__________mol·L—1min—1,CO的转化率为_________。
(3)下列措施中,既能加快反应速率又能提高CH3OCH3产率的有___________。
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率原因是_________________________。
【答案】 -263 kJmol-1 K12·K2·K3 0.12mol·L1·min1 60% D 反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率
【解析】(1)由盖斯定律可得,总反应3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g)为方程式①×2+②+③相加所得,故△H=2△H1+△H2+△H3=2×(-99)-24-41=-263 kJ·mol-1;总反应的平衡常数等于分反应的平衡常数之积,则K=K12·K2·K3 .
CH3OCH3(g)+CO2(g)为方程式①×2+②+③相加所得,故△H=2△H1+△H2+△H3=2×(-99)-24-41=-263 kJ·mol-1;总反应的平衡常数等于分反应的平衡常数之积,则K=K12·K2·K3 .
(2)可用体积分数求出各物质的浓度,然后再利用平衡常数的公式求出平衡常数,相同条件下,气体的体积分数等于其物质的量分数,设参加反应的n(CO)=xmol,
该反应中 4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
开始(mol) 8.0 4.0 0 0
反应(mol) 2x x 0.5x 0.5x
平衡(mol)8.0-2x 4.0-x 0.5x 0.5x
二甲醚物质的量分数=![]() ×100%=1/6,解得:x=2.4;用CH3OCH3的浓度变化表示该反应的速率为
×100%=1/6,解得:x=2.4;用CH3OCH3的浓度变化表示该反应的速率为![]() =0.12mol·L1·min1 ;则CO的转化率为2.4mol/4mol×100%=60%;(3)A、分离出二甲醚,降低生成物浓度,减慢反应速率,故A错误;B、升高温度,加快反应速率,平衡逆向移动,产率降低,故B错误;C、改用高效催化剂,加快反应速率,但平衡不移动,故C错误;D、增大压强,加快反应速率,平衡正向移动,能加快反应速率又能提高CH3OCH3产率,D正确;故选D。(4)该工艺中反应③的发生提高了CH3OCH3的产率原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率。
=0.12mol·L1·min1 ;则CO的转化率为2.4mol/4mol×100%=60%;(3)A、分离出二甲醚,降低生成物浓度,减慢反应速率,故A错误;B、升高温度,加快反应速率,平衡逆向移动,产率降低,故B错误;C、改用高效催化剂,加快反应速率,但平衡不移动,故C错误;D、增大压强,加快反应速率,平衡正向移动,能加快反应速率又能提高CH3OCH3产率,D正确;故选D。(4)该工艺中反应③的发生提高了CH3OCH3的产率原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率。

【题目】气体是物质聚集状态的重要形式之一,在实验室或工业上经常需制备气体。以下是某同学设计的实验室制备氨气的一些装置。
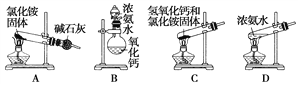
(1)上面是实验室制取氨气的装置和选用的试剂,其中不能得到氨气的是________(填字母)。
(2)利用装置B和下列提供的试剂,能制备的下列气体有________________(填气体的化学式)。
气体 | 所用试剂 |
SO2 | NaHSO3(固)+H2SO4(浓) |
Cl2 | MnO2(固)+HCl(浓) |
H2S | Na2S(固)+H2SO4(浓) |
O2 | Na2O2 (固)+H2O |
(3)实验室制备、收集干燥的NO2,所需仪器如图所示,按气流方向连接各仪器接口,顺序为a→________→________→________→________→f。装置D的作用是__________________________,装置E中盛放的溶液是________。制备时,烧瓶中装少量铜片,从分液漏斗向烧瓶中滴加浓硝酸,烧瓶中的现象是__________________________________________________________________。