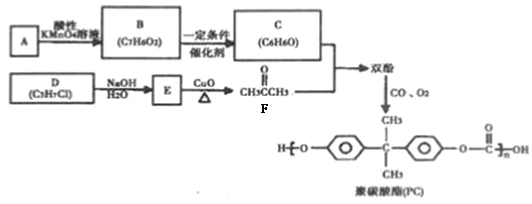
题目内容
【题目】a、b、c、d是四种短周期元素,a、b、d同周期,c、d同主族,a的原子结构示意图为:![]() ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构。下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构。下列比较中,正确的是( )
A. 原子序数:a>b>c B. 元素的非金属性:d>a>c
C. 原子半径:c>a>d D. 最高价含氧酸的酸性:d>c>a
【答案】A
【解析】
由原子核外电子排布规律知,a的原子结构示意图中x=2,则a为Si;由b、c形成的化合物的化学式及a、b、d位于同周期,c、d同主族,b、c离子有相同的电子层结构,故b为Na,c为N,d为P,则四种元素在周期表中的位置为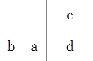 。A.原子序数顺序为a>b>c,故正确;B.元素的非金属性顺序为:c >d>a,故错误;C.原子半径顺序为a>d>c,故错误;D.最高价氧化物含氧酸的酸性顺序为c>d>a,故错误。故选A。
。A.原子序数顺序为a>b>c,故正确;B.元素的非金属性顺序为:c >d>a,故错误;C.原子半径顺序为a>d>c,故错误;D.最高价氧化物含氧酸的酸性顺序为c>d>a,故错误。故选A。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目