题目内容
19.在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,HNO3是氧化剂,Cu是还原剂,Cu元素被氧化,Cu(NO3)2是氧化产物,被还原的HNO3与参加反应的HNO3物质的量之比是1:4.分析 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,Cu元素的化合价升高,N元素的化合价降低,以此来解答.
解答 解:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,N元素的化合价降低,则HNO3为氧化剂,Cu元素的化合价升高,则Cu为还原剂,Cu失去电子被氧化,对应氧化产物为Cu(NO3)2,由反应及N原子守恒可知,8mol硝酸反应只有2mol作氧化剂,则被还原的HNO3与参加反应的HNO3物质的量之比是2mol:8mol=1:4,
故答案为:HNO3;Cu;Cu(NO3)2;1:4.
点评 本题考查氧化还原反应,为高频考点,把握氧化还原反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
9.有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有如图所示的关系.则下列推断不正确的是( )
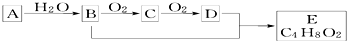

| A. | 鉴别A和甲烷可选择酸性高锰酸钾溶液 | |
| B. | B、D均能与金属钠反应 | |
| C. | 物质C的结构简式为CH3CHO | |
| D. | B+D→E的化学方程式为:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5 |
7.下列叙述中,正确的是( )
| A. | 氧化还原反应的本质是元素化合价发生了变化 | |
| B. | 氧化还原反应的本质是反应中有电子的转移(得失或偏移) | |
| C. | 氧化剂在反应中被氧化 | |
| D. | 氧化反应一定先于还原反应发生 |
14.0.5L 1mol/L FeCl3溶液与3L 0.5mol/L KCl溶液中的Cl-的数目之比( )
| A. | 1:6 | B. | 1:1 | C. | 2:1 | D. | 3:1 |
4.在汽车加油站见到的油罐车上,所贴的危险化学品标志是( )
| A. |  腐蚀品 | B. |  爆炸品 | C. |  有毒气体 | D. |  易燃液体 |
11.以NA代表阿伏加德罗常数的值,则关于热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1 300kJ•mol-1的说法中,正确的是( )
| A. | 当5NA个电子转移时,该反应放出1 300 kJ的能量 | |
| B. | 当NA个水分子生成且为液体时,吸收1 300 kJ的能量 | |
| C. | 当2NA个碳氧共用电子对生成时,放出1 300 kJ的能量 | |
| D. | 当8NA个碳氧共用电子对生成时,放出1 300 kJ的能量 |
8.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 17gNH3所含电子数为10NA | |
| B. | 在常温常压下,11.2LN2所含原子数为NA | |
| C. | 4g氦气所含原子数为NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相等 |
16.下列物质既能与稀盐酸反应,又能与氢氧化钠溶液反应的是( )
| A. | Fe | B. | SiO2 | C. | Al(OH)3 | D. | CaCO3 |