题目内容
10.已知0.1mol X2O72-能将100mL,3mol/L SO32- 氧化成SO42-,则X元素被还原后的化合价是( )| A. | 0 | B. | +2 | C. | +3 | D. | +4 |
分析 0.1molX2O72-能使100mL,3mol/L即0.3molSO32-完全氧化成SO42-,则S元素的化合价由+4价升高为+6价,所以X元素的化合价降低,设X2O72-被还原后X的化合价为x,利用电子守恒来计算x即可.
解答 解:0.1molX2O72-能使100mL,3mol/L即0.3molSO32-完全氧化成SO42-,则S元素的化合价由+4价升高为+6价,所以X元素的化合价降低,
设X2O72-被还原后X的化合价为x,
由电子守恒可得:0.1mol×2×(6-x)=0.3mol×(6-4),
解得x=+3,
故选C.
点评 本题考查氧化还原反应的计算,题目难度中等,明确氧化还原反应中电子守恒是解答本题的关键,注意氧化剂中X的原子个数为解答的易错点,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
20.下列物质中能抑制水的电离且使溶液呈现出酸性的是( )
| A. | Na2CO3 | B. | NaOH | C. | K2SO4 | D. | H2SO4 |
1.某温度下,在体积固定不变的密闭容器中进行如下可逆反应:X(g)+Y(g)?Z(g)+W(s)△H>0,下列叙述不正确的是( )
| A. | 当容器中气体压强不变时,反应达到平衡 | |
| B. | 升高温度,平衡正向移动 | |
| C. | 加入少量W,逆反应速率增大 | |
| D. | 当气体密度不变时,说明反应达到平衡 |
18.下列溶液中Cl-浓度与50mL 1mol•L-1 AlCl3溶液中Cl-浓度相等的是( )
| A. | 150 mL 1 mol•L-1的NaCl溶液 | B. | 75 mL 2 mol•L-1NH4Cl溶液 | ||
| C. | 75 mL 1 mol•L-1的FeCl3溶液 | D. | 150 mL 2 mol•L-1的KCl溶液 |
5.下列表示物质结构的化学用语或模型正确的是( )
| A. | 羟基的电子式: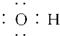 | B. | 溴乙烷的电子式: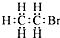 | ||
| C. | 乙醇的结构简式:CH3CH2OH | D. | CH4分子的球棍模型: |
15.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 10g甲烷中所含有的电子数目为10NA | |
| B. | 常温常压下,4g氦气所含有的质子数目为4NA | |
| C. | 标准状况下,22.4L单质溴所含有的原子数目为2NA | |
| D. | Fe-Cu和稀硫酸构成的原电池中,若生成2gH2,则转移的电子数目为2NA |
2.下列方法可使海水转化为饮用水的是( )
| A. | 过滤 | B. | 蒸馏 | C. | 活性炭吸附 | D. | 静置沉淀 |
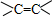 、醛基-CHO、羧基-COOH、-COOR酯基.
、醛基-CHO、羧基-COOH、-COOR酯基.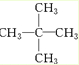 ,名称为2,2-二甲基丙烷.
,名称为2,2-二甲基丙烷.