��Ŀ����
����Ŀ�������仯���������ǵ����������
(1)����β����NO���ɹ��̵������仯ʾ��ͼ���£�

�������£�1mol N2��1molO2��ȫ��Ӧ����NO����_______________(���������������ų���)________kJ������
(2)һ���¶��£������Ϊ0.5 L�ĺ����ܱ������У�������̬������X��Y֮�䷴Ӧ�����и����ʵ����ʵ�����ʱ��Ĺ�ϵ��ͼ��ʾ��
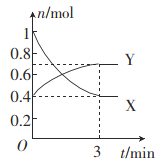
�ٸ÷�Ӧ�Ļ�ѧ��Ӧ����ʽ��______________________��
����0��3 min�ڣ���Y��ʾ�ķ�Ӧ����Ϊ____________��
������������˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����________(����ĸ)��
a��������ѹǿ���ٷ����仯
b��X������������ٷ����仯
c��������ԭ���������ٷ����仯
d����ͬʱ��������nmolY��ͬʱ����2nmol X
�ܷ�Ӧ�ﵽƽ����������¶ȣ�����(��)______����(��)________��(��������������С������������)��
(3)��Ӧ A(g)+3B(g)�T2C(g)+3D(g)�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��
���� (A)=0.015mol (Ls)��1 ���� (B)=0.09mol (Ls)��1
���� (C)=2.4mol (Lmin )��1 ���� (D)=0.045mol (Ls)��1
�÷�Ӧ�����ֲ�ͬ����������ɴ�С��˳��Ϊ(��������)________��
���𰸡����� 183 2XY 0.2mol/(L��min) ab ��С ��С ��>��>��=��
��������
(1)���ϼ����յ����������ڳɼ��ų���������Ϊ���ȷ�Ӧ����֮Ϊ���ȷ�Ӧ��
(2) �ٷ�Ӧ������ʵ������٣�����������ʵ��������࣬�������ʵ����ı仯�жϼ�����֮��Ĺ�ϵ��
�ڸ���![]() ����������Y��ʾ��ƽ����Ӧ���ʣ�
����������Y��ʾ��ƽ����Ӧ���ʣ�
�۸���ƽ���־�ж��Ƿ�ﵽƽ��״̬��
�ܽ����¶ȷ�Ӧ����һ����С��
(3)���ݷ�Ӧ����֮�ȵ��ڻ�ѧ������֮���жϡ�
(1)����ͼʾ���ϼ����յ���������945 kJ +498 kJ =1443kJ���ɼ��ų���������Ϊ2mol��630 kJ/mol=1260 kJ���ų�������С�����յ�����������1mol N2��1molO2��ȫ��Ӧ����NO��������1443kJ-1260kJ=183kJ��������
(2) ����ͼ���֪�� Y�����ʵ��������࣬X�����ʵ������٣���XΪ��Ӧ�YΪ���������ȵ�ʱ����X��Y�����ʵ����仯֮��Ϊ0.6:0.3=2:1�����Է�Ӧ����ʽӦΪ��2XY��
�ڸ���![]() 0.2mol/(L��min)��
0.2mol/(L��min)��
��a��2XY��Ӧǰ���������ʵ����DZ������ں�����������ѹǿ�DZ�������ѹǿ���ٷ����仯һ��ƽ�⣬��ѡa��
b��X������������ٷ����仯��˵��X��Ũ�Ȳ��ٱ仯��һ���ﵽƽ��״̬����ѡb��
c�����������غ㣬ԭ�������Ǻ�����������ԭ���������ٷ����仯����һ��ƽ�⣬�ʲ�ѡc��
d����ͬʱ��������nmolY��ͬʱ����2nmol X�������淴Ӧ���ʣ������Ƴ����淴Ӧ������ȣ���һ��ƽ�⣬��ѡd��
�ܽ����¶ȷ�Ӧ���ʼ�С�����Է�Ӧ�ﵽƽ����������¶ȣ����(��)��С����(��)��С��
(3) �٦� (A) ��1=0.015mol (Ls)��1��1=0.015mol (Ls)��1��
�ڦ� (B) ��3=0.09mol (Ls)��1��3=0.03mol (Ls)��1
�ۦ� (C) ��2=2.4mol (Lmin )��1��2=1.2mol (Lmin )��1=0.02 mol (Ls)��1
�ܦ� (D) ��3=0.045mol (Ls)��1��3=0.015mol (Ls)��1�������ɴ�С��˳��Ϊ��>��>��=�ܡ�

����Ŀ��ijС������H2C2O4��Һ�������ữ��KMnO4��Һ��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족��ʵ��ʱͨ���ⶨ����KMnO4��Һ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�������С����������·�������֪��2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2��+8H2O
ʵ���� | 0.1mol/L����KMnO4��Һ�����/mL | 0.6mol/LH2C2O4��Һ�����/mL | H2O�����/mL | ʵ���¶�/�� | ��Һ��ɫ����ʱ��/min |
�� | 10 | V1 | 35 | 25 | |
�� | 10 | 10 | 30 | 25 | |
�� | 10 | 10 | V2 | 50 |
��1������V1=_______mL��V2=_______mL��
��2��̽���¶ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________(���ţ���ͬ)����̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________��
��3��ʵ��ٲ��KMnO4��Һ����ɫʱ��Ϊ2min�����Ի��ǰ����Һ�����С�仯�����ʱ����ƽ����Ӧ����v(H2C2O4)��________mol��L��1��min��1��

