题目内容
10.下列叙述错误的是( )| A. | 酸性高锰酸钾和草酸的反应中,加硫酸锰可大大加快反应速率 | |
| B. | 硫代硫酸钠和硫酸的反应中有硫和二氧化硫产生 | |
| C. | 同一反应,不同催化剂的催化效果不一样 | |
| D. | H2O2的分解的方程式:H2O2$\frac{\underline{\;MnO_2\;}}{\;}$ H2↑+O2↑ |
分析 A.锰离子在该反应这起到了催化作用;
B.硫代硫酸钠在酸性条件下发生反应生产S和二氧化硫;
C.在相同反应这,催化剂不同,催化效果不同;
D.双氧水在二氧化锰作催化剂条件下发生分解反应生产氧气和水.
解答 解:A.向草酸与酸性高锰酸钾反应的溶液中加硫酸锰固体,硫酸锰起到催化剂的作用,可增大反应速率,故A正确;
B.硫代硫酸钠和硫酸反应生产硫酸钠、硫和二氧化硫气体,故B正确;
C.同一化学反应,催化剂不同,其催化效果会不同,故C正确;
D.双氧水分解的方程式为:22O2$\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑,故D错误;
故选D.
点评 本题考查了催化剂对反应速率的影响、双氧水的性质等知识,题目难度不大,明确影响化学反应速率的因素为解答关键,注意掌握双氧水、硫代硫酸钠等物质具有的化学性质.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
20.往溴水中加入苯后,振荡、静置,溴水层颜色变浅,这是由于( )
| A. | 溴挥发出了 | B. | 发生了取代反应 | C. | 发生了加成反应 | D. | 发生了萃取 |
1.下表是某食品包装袋上的说明.
(1)其中属于营养强化剂的有(填一种,下同)维生素C,属于防腐剂的有山梨酸钾.
(2)下列关于食品添加剂的说法中,正确的是c.
a.为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠
b.为了使婴儿食品的色泽诱人,可以加少量着色剂
c.为了预防地方性甲状腺肿,可以在食盐中加适量碘酸钾
(3)医学科学家们研究发现,食物中除糖类、脂肪、蛋白质外,还有一类物质与人体健康有着密切关系,它们就是维生素.下列维生素中,属于脂溶性维生素的是a(填序号,下同),可用于防治坏血病的是d.
a.维生素A b.维生素B1 c.维生素B2 d.维生素C.
| 品 名 | 浓缩菠萝汁 |
| 配 料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、黄原胶、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等 |
| 果汁含量 | ≥80% |
| 生产日期 | 标于包装袋封口上 |
(2)下列关于食品添加剂的说法中,正确的是c.
a.为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠
b.为了使婴儿食品的色泽诱人,可以加少量着色剂
c.为了预防地方性甲状腺肿,可以在食盐中加适量碘酸钾
(3)医学科学家们研究发现,食物中除糖类、脂肪、蛋白质外,还有一类物质与人体健康有着密切关系,它们就是维生素.下列维生素中,属于脂溶性维生素的是a(填序号,下同),可用于防治坏血病的是d.
a.维生素A b.维生素B1 c.维生素B2 d.维生素C.
5.一定条件下反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是( )
| A. | 单位时间内生成nmolA2,同时消耗2n molAB | |
| B. | 容器内压强不随时间而变化 | |
| C. | AB的消耗速率等于A2的消耗速率 | |
| D. | 容器中各组分的体积分数不随时间变化 |
15.下列各组物质互为同素异形体的是( )
| A. | 12C和14C | B. | H2O和D2O | C. | O2和O3 | D. | 淀粉和纤维素 |
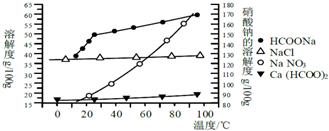
3.某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:
a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
请补充完整由碳酸钙制备甲酸钙的实验步骤
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2.用稍过量硝酸溶解碳酸钙样品.
步骤3.用石灰水调整溶液pH=5.
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩(蒸发结晶)、趁热过滤、洗涤干燥得甲酸钙晶体.
a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2.用稍过量硝酸溶解碳酸钙样品.
步骤3.用石灰水调整溶液pH=5.
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩(蒸发结晶)、趁热过滤、洗涤干燥得甲酸钙晶体.

20.晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等,.以下是工业上制取纯硅的一种方法.

已知:在一定条件下可发生反应:Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0
Ⅰ.反应②、③均需要加热,有如下两个温度区间分别供两反应选择,你认为反应②应选择a
(填序号字母),原因是因反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0,温度较低时反应向正向进行程度较大,有利于SiHCl3的生成;
a.520~530K b.1350~1360K
Ⅱ.现在实验室模拟工业上粗硅提纯的过程,已知SiHCl3遇水强烈水解,其他相关数据如下表所示:
(1)现用如下装置(如图1)进行模拟反应②的过程.实验室制HCl的反应原理为:
2NaCl(s)+H2SO4(浓) QUOTE 2HCl↑+Na2SO4
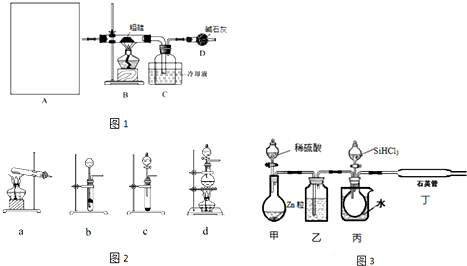
A中是HCl的发生装置,你认为应选择下列哪套装置?d(填装置的序号字母),装置D中碱石灰的作用为吸收剩余HCl、防止空气中的水蒸气进入C装置造成SiHCl3的水解;
(2)已知液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,则流程中操作①为分馏(填操作名称),下列不是该操作所需的仪器是(如图2)bd(填装置序号字母);
a.冷凝管 b.圆底烧瓶 c.蒸馏烧瓶 d.分液漏斗 e.温度计 f.接受器
(3)用SiHCl3与H2反应制备纯硅的装置如图3:
①按图示组装好仪器后,下列实验步骤的正确顺序为dbacef(填步骤的序号字母),
a.打开甲装置分液漏斗旋塞,滴加稀硫酸,反应生成H2;
b.向装置中添加药品;
c.打开丙装置分液漏斗的旋塞,滴加SiHCl3,并加热相应装置;
d.检查装置气密性;
e.停止向丙装置滴加SiHCl3,并停止加热相应装置;
f.停止通H2;
步骤c中需要加热的装置为丙、丁(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是无尾气处理装置.

已知:在一定条件下可发生反应:Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0
Ⅰ.反应②、③均需要加热,有如下两个温度区间分别供两反应选择,你认为反应②应选择a
(填序号字母),原因是因反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0,温度较低时反应向正向进行程度较大,有利于SiHCl3的生成;
a.520~530K b.1350~1360K
Ⅱ.现在实验室模拟工业上粗硅提纯的过程,已知SiHCl3遇水强烈水解,其他相关数据如下表所示:
| 物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 33.0 | - | 315 |
| 升华温度/℃ | - | - | 180 | 300 |
2NaCl(s)+H2SO4(浓) QUOTE 2HCl↑+Na2SO4

A中是HCl的发生装置,你认为应选择下列哪套装置?d(填装置的序号字母),装置D中碱石灰的作用为吸收剩余HCl、防止空气中的水蒸气进入C装置造成SiHCl3的水解;
(2)已知液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,则流程中操作①为分馏(填操作名称),下列不是该操作所需的仪器是(如图2)bd(填装置序号字母);
a.冷凝管 b.圆底烧瓶 c.蒸馏烧瓶 d.分液漏斗 e.温度计 f.接受器
(3)用SiHCl3与H2反应制备纯硅的装置如图3:
①按图示组装好仪器后,下列实验步骤的正确顺序为dbacef(填步骤的序号字母),
a.打开甲装置分液漏斗旋塞,滴加稀硫酸,反应生成H2;
b.向装置中添加药品;
c.打开丙装置分液漏斗的旋塞,滴加SiHCl3,并加热相应装置;
d.检查装置气密性;
e.停止向丙装置滴加SiHCl3,并停止加热相应装置;
f.停止通H2;
步骤c中需要加热的装置为丙、丁(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是无尾气处理装置.
1.如表是不同温度下水的离子积数据:
试回答以下几个问题:
(1)若25<t1<t2,则a>1×10-14(填“<”、“>”或“=”);
(2)在25℃下,0.05mol/L的Ba(OH)2溶液的pH=13;
(3)在25℃下,pH=10的NaOH溶液中,水电离产生的c(OH-)为:1×10-10mol/L;
(4)在t2℃下,将pH=9的氢氧化钠溶液V1L与pH=4的硫酸溶液V2L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=7,则V1:V2=$\frac{1}{9}$.
| 温度/℃ | 25 | t1 | t2 |
| Kw/mol2•L-2 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a>1×10-14(填“<”、“>”或“=”);
(2)在25℃下,0.05mol/L的Ba(OH)2溶液的pH=13;
(3)在25℃下,pH=10的NaOH溶液中,水电离产生的c(OH-)为:1×10-10mol/L;
(4)在t2℃下,将pH=9的氢氧化钠溶液V1L与pH=4的硫酸溶液V2L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=7,则V1:V2=$\frac{1}{9}$.