题目内容
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 ( )
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| B.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| C.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| D.氨气分子是极性分子而甲烷是非极性分子。 |
B
解析试题分析:在氨气分子在N原子是sp3杂化,甲烷分子在C原子也是sp3杂化。之所以NH3空间构型是三角锥形,而CH4是正四面体形型,是因为在NH3分子中的N原子上有一对未成键的孤对电子,它对成键电子的排斥作用较强。使三个H原子在一侧,N在另一侧。而不是各个化学键对称排列。因此选项为B。
考点:考查分子的空间构型与组成的原子的杂化方式的关系的知识。

练习册系列答案
相关题目
下列有关说法正确的是
| A.水分子间的作用力强于分子内的H-O键 |
| B.形成化学键的微粒只能是离子 |
| C.含有离子键的化合物一定是离子化合物 |
| D.共价化合物分子里的化学键只能是极性键 |
下列各分子中,所有原子都满足最外层为8电子结构的是
| A.H2O | B.NH3 | C.Cl2 | D.BCl3 |
下列各组物质,化学键类型相同、晶体类型相同且熔化时破坏作用力类型也相同的 ( )
| A.HCl KCl | B.CO2 SiO2 | C.NH4Cl CCl4 | D.NaOH Na2O2 |
下列化合物中含有手性碳原子的是
| A.CCl2F2 | B.CH3CH3 | C.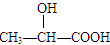 | D.CH3CH2OH |
下列物质中,既有离子键,又有非极性共价键的是
| A.H2O | B.CaCl2 | C.KOH | D.Na2O2 |
甲烷分子(CH4)失去一个H+,形成甲基阴离子(CH3-),在这个过程中,下列描述不合理的是( )
| A.碳原子的杂化类型发生了改变 |
| B.微粒的形状发生了改变 |
| C.微粒的稳定性发生了改变 |
| D.微粒中的键角发生了改变 |
下列各组物质中,化学键的类型相同的是( )
| A.CaCl2和Na2S | B.Na2O和Na2O2 |
| C.N2和Ne | D.HCl和NaOH |
下列各种说法中一定正确的是( )
| A.过渡金属的原子或离子一般都有接受孤电子对的空轨道,易形成配合物 |
| B.中心原子或离子采取sp3杂化轨道形成的配离子均呈正四面体结构 |
| C.当中心原子或离子的配位数为6时,配离子一定呈八面体结构 |
| D.含有两种配位体且配位数为4的配离子一定存在顺反异构体 |