题目内容
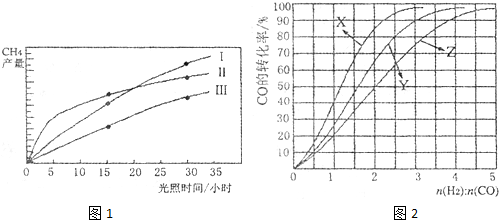
(12分)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图所示。
(1)在0-15小时内,CH4的平均生成速率 vⅠ、vⅡ和v Ⅲ 从大到小的顺序为 ;
反应开始后的30小时内,在第 种催化剂的作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)CO(g)+3H2(g),该反应的△H=+206 kJ•mol-1
①在答题卡的坐标图中,画出反应过程中体系的能量变化图(进行必要的标注)
②将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率(计算结果保留两位有效数字)。
(3)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) H= -890kJ·mol-1,现有甲烷和一氧化碳的混合气体共0.75mol,完全燃烧后生成气态二氧化碳和18g液态水,并放出515kJ热量,请写出一氧化碳燃烧的热化学方程式__________________ 。
(共12分)
(1)vⅡ>vⅠ>vⅢ(2分) Ⅲ(2分)
(2)①(2分)图略,划出正确能量变化1分,标出反应热1分
②设开始时通入CO和H2(g)的物质的量浓度分别为a
CH4 (g)+H2O(g) CO(g)+3H2(g)
开始物质的量浓度(mol/L) a a 0 0
转化物质的量浓度(mol/L) 0.1 0.1 0.1 0.3
平衡物质的量浓度(mol/L) a-0.1 a-0.1 0.1 0.1 (2分)
 因为 K=
因为 K== = 27, 所以得a=0.11mol/L(1分)
CO的转化率==91%(1分)
(3)CO(g)+1/2O2(g)=CO2(g) △H=―280kJ/mol (2分)
解析:略

 名校课堂系列答案
名校课堂系列答案
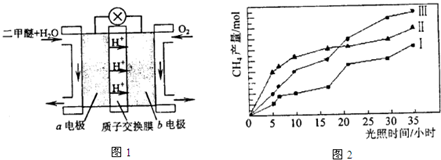

 (2011?广东)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图所示.
(2011?广东)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图所示.