题目内容
5.下列说法不正确的是( )| A. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染” | |
| B. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 | |
| C. | pH计也可用于酸碱中和滴定终点的判断 | |
| D. | 海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t.由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素” |
分析 A.白色污染是指不能降解的聚乙烯塑料;
B.某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等;
C.在酸碱中和滴定过程中,滴定终点判断的主要依据是溶液的pH值变化,测量溶液pH可以用pH试纸、pH计、酸碱指示剂;
D.溴元素被称为海洋元素;
解答 解:A.利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代不能降解的聚乙烯塑料,可减少白色污染,故A正确;
B.某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等,故B正确;
C.在酸碱中和滴定过程中,滴定终点判断的主要依据是溶液的pH值变化,测量溶液pH可以用pH试纸、pH计、酸碱指示剂.pH计是一种精确测量溶液pH的仪器,精确度高,测量时可以从仪器上直接读出溶液的pH,所以,可以在酸碱中和滴定过程中用来确定和判断滴定终点,故C正确;
D.溴元素被称为海洋元素,镁为国防金属,故D错误;
故选:D.
点评 本题考查了环境污染及治理、铝硅酸盐的用途、pH计的用途,海水中的元素,明确白色污染的原因、铝硅酸盐的性质是解题关键,注意对相关知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列元素中,原子半径最小的是( )
| A. | Na | B. | K | C. | Cl | D. | F |
13.化学反应A2+B2═2AB的能量变化如图所示,则下列说法正确的是( )


| A. | 因为该反应为放热反应,故不必加热反应就可发生 | |
| B. | 断裂1 mol A-A 键和1 mol B-B 键放出x kJ能量 | |
| C. | 断裂2 mol A-B 键需要吸收y kJ的能量 | |
| D. | 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
20.某小组设计如图装置研究电化学原理,下列说法中错误的是( )
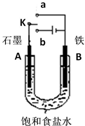

| A. | 若开始时开关K与a连接,其反应与铁的吸氧腐蚀类似 | |
| B. | 若开始时开关K与b连接,其原理类似于钢铁防护中外加电流的阴极保护法 | |
| C. | 若开始时开关K与b连接,则标准状况下B极产生2.24 L气体,转移电子0.2 mol | |
| D. | 若开始时开关K与b连接,则反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同) |
14.有机物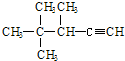 的系统名称为( )
的系统名称为( )
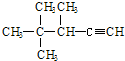 的系统名称为( )
的系统名称为( )| A. | 2,2,3-三甲基-1-戊炔 | B. | 3,4,4-三甲基-4-戊炔 | ||
| C. | 3,4,4-三甲基-1-戊炔 | D. | 2,2,3-三甲基-4-戊炔 |
 .
.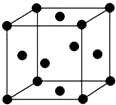 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
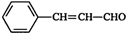 ,肉桂醛分子结构中有6种不同化学环境的氢原子.
,肉桂醛分子结构中有6种不同化学环境的氢原子.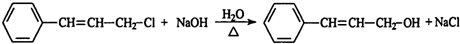 ,B转化为肉桂醛的反应条件为Cu/Ag加热.
,B转化为肉桂醛的反应条件为Cu/Ag加热. .
.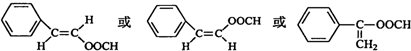 .
.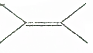 的二氯代物有4种.
的二氯代物有4种.