题目内容
【题目】钴的某些化合物与铁的化合物性质相似,某研究性学习小组为探究钴的化合物的性质,进行了以下实验:
Ⅰ探究草酸钴的热分解产物
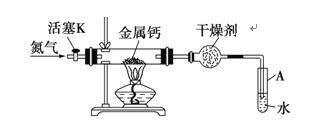
(1)为探究草酸钴的热分解产物,按气体流动方向,各装置的连接顺序为:A→E→_____。

(2)能验证分解产物中有CO的实验现象是_____。
(3)取3.66g CoC2O42H2O于硬质玻璃管中加热至恒重,冷却、称量,剩余固体的质量为1.5g,球形干燥管增重0.88g。则A中发生的反应方程式为_____。
Ⅱ探究Co(OH)2的还原性及Co(OH)3的氧化性
取A装置所得固体溶解于稀H2SO4中得到粉红色溶液,备用。
已知试剂颜色:CoSO4溶液(粉红色),Co(OH)2(粉红色),Co(OH)3(棕褐色)。
实验记录如下表:
实验操作及现象 | 实验分析 | |
实验1 | 取少许粉红色溶液于试管中,滴加0.1moL﹣1NaOH溶液,生成粉红色沉淀并将该沉淀分成两份 | |
实验2 | 取一份实验1中所得的粉红色沉淀,加入3%的H2O2溶液,粉红色沉淀立即变为棕褐色。 | 反应的化学方程式为①_____ |
实验3 | 向实验2得到的棕褐色沉淀中滴加浓盐酸固体逐渐溶解,并有黄绿色气体产生。 | 反应的离子方程式为②_____ |
实验4 | 取另一份实验1中所得的粉红色沉淀滴加浓盐酸,粉红色沉淀溶解,未见气体生成。 | 酸性条件下,Cl2、Co(OH)2、Co(OH)3的氧化能力由大到小的顺序是③________ |
【答案】C→D→B 装置D中氧化铜由黑色变化为红色 CoC2O42H2O ![]() CoO+CO2↑+CO↑+2H2O 2Co(OH)2+H2O2=2Co(OH)3 2Co(OH)3+6H++2Cl﹣=Cl2↑+2Co2++6H2O Co(OH)3>Cl2>Co(OH)2
CoO+CO2↑+CO↑+2H2O 2Co(OH)2+H2O2=2Co(OH)3 2Co(OH)3+6H++2Cl﹣=Cl2↑+2Co2++6H2O Co(OH)3>Cl2>Co(OH)2
【解析】
Ⅰ.(1)装置A中草酸钴受热分解,生成的气体通过装置E中浓硫酸吸收水蒸气,通过装置C中碱石灰吸收生成的二氧化碳,通过装置D验证生成的一氧化碳和氧化铜反应生成红色铜,剩余CO用装置B吸收;
(2)一氧化碳能还原氧化铜生成红色铜;
(3)结合原子守恒计算出反应物、生成物的物质的量,根据物质的量之比等于化学计量数之比写出方程式;
Ⅱ.(4)①CoSO4溶液(粉红色),滴加0.1moL﹣1NaOH溶液,生成粉红色沉淀为Co(OH)2(粉红色),将该沉淀分成两份,一份中加入3%的H2O2溶液,粉红色沉淀立即变为棕褐色说明Co(OH)2被氧化为Co(OH)3(棕褐色);
②向实验2得到的棕褐色沉淀中滴加浓盐酸固体逐渐溶解,并有黄绿色气体产生,说明生成的为氯气,发生的反应是氧化还原反应,Co(OH)3氧化氯离子生成氯气;
③取另一份实验1中所得的粉红色沉淀滴加浓盐酸,粉红色沉淀溶解,未见气体生成,说明Co(OH)2不具有氧化性不能氧化氯离子生成氯气,氧化还原反应中,根据氧化剂的氧化性大于氧化产物的氧化性判断;
Ⅰ.(1)装置A中草酸钴受热分解,生成的气体通过装置E中浓硫酸吸收水蒸气,通过装置C中碱石灰吸收生成的二氧化碳,通过装置D验证生成的一氧化碳和氧化铜反应生成红色铜,剩余CO用装置B吸收,探究草酸钴的热分解产物,按气体流动方向,各装置的连接顺序为:A→E→C→D→B,
答案:C→D→B;
(2)一氧化碳具有还原性,能还原氧化铜生成红色铜,实验装置和过程分析可知,能验证分解产物中有CO的实验现象是:装置D中氧化铜由黑色变化为红色,
答案:装置D中氧化铜由黑色变化为红色;
(3)取3.66g CoC2O42H2O物质的量=![]() =0.02mol,于硬质玻璃管中加热至恒重,冷却、称量,剩余固体的质量为1.5g,球形干燥管增重0.88g为吸收的二氧化碳,物质的量n(CO2)=
=0.02mol,于硬质玻璃管中加热至恒重,冷却、称量,剩余固体的质量为1.5g,球形干燥管增重0.88g为吸收的二氧化碳,物质的量n(CO2)=![]() =0.02mol,碳元素守恒得到生成CO物质的量0.02mol,生成钴的氧化物中钴元素物质的量0.02mol,摩尔质量=
=0.02mol,碳元素守恒得到生成CO物质的量0.02mol,生成钴的氧化物中钴元素物质的量0.02mol,摩尔质量=![]() =75g/mol,氧化物为CoO,生成水物质的量0.04mol,结合原子守恒配平书写化学方程式:CoC2O42H2O
=75g/mol,氧化物为CoO,生成水物质的量0.04mol,结合原子守恒配平书写化学方程式:CoC2O42H2O![]() CoO+CO2↑+CO↑+2H2O,
CoO+CO2↑+CO↑+2H2O,
答案:CoC2O42H2O![]() CoO+CO2↑+CO↑+2H2O;
CoO+CO2↑+CO↑+2H2O;
Ⅱ.(4)①CoSO4溶液(粉红色),滴加0.1moL﹣1NaOH溶液,生成粉红色沉淀为Co(OH)2(粉红色),将该沉淀分成两份,一份中加入3%的H2O2溶液,粉红色沉淀立即变为棕褐色说明Co(OH)2被氧化为Co(OH)3(棕褐色),反应的化学方程式:2Co(OH)2+H2O2=2Co(OH)3,
答案:2Co(OH)2+H2O2=2Co(OH)3;
②向实验2得到的棕褐色沉淀中滴加浓盐酸固体逐渐溶解,并有黄绿色气体产生,说明生成的为氯气,发生的反应是氧化还原反应,Co(OH)3氧化氯离子生成氯气,反应的化学方程式:2Co(OH)3+6H++2Cl﹣=Cl2↑+2Co2++6H2O,
答案:2Co(OH)3+6H++2Cl﹣=Cl2↑+2Co2++6H2O;
③取另一份实验1中所得的粉红色沉淀滴加浓盐酸,粉红色沉淀溶解,未见气体生成,说明Co(OH)2不具有氧化性不能氧化氯离子生成氯气,氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,酸条件下,Cl2、Co(OH)2、Co(OH)3的氧化能力由大到小的顺序是:Co(OH)3>Cl2>Co(OH)2,
答案:Co(OH)3>Cl2>Co(OH)2。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案