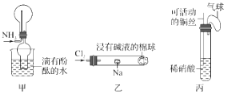
题目内容
【题目】(一)有以下几种物质:①碳酸氢钠晶体 ②液态氯化氢 ③铁 ④蔗糖 ⑤酒精 ⑥熔融的K2SO4 ⑦干冰 ⑧石墨。试回答(填序号):
(1)以上物质能导电的是_________________________。
(2)以上物质中属于非电解质的是_________________________。
(3)以上物质中溶于水后水溶液能导电的是_________________________。
(4)①、②在水溶液中反应的离子方程式为_________________________________。
(二)某溶液的溶质可能由下列离子组成:Cl-、![]() 、
、![]() 、H+、Ba2+、Na+,某同学进行了如下实验:
、H+、Ba2+、Na+,某同学进行了如下实验:
Ⅰ 向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
Ⅱ 向Ⅰ中滤液中加入AgNO3溶液,有白色沉淀产生;
Ⅲ 将Ⅰ中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生。
(5)依据以上实验可以推断,原溶液中一定含有____________ (用离子符号表示,下同);一定没有______________;可能含有________________,检验是否存在该离子的方法为_____________________________________________。
【答案】③⑥⑧ ④⑤⑦ ①②⑥⑦ H++HCO3-== H2O+ CO2↑ SO42-、CO32-、Na+ H+、Ba2+ Cl- 取少量溶液于试管中,向溶液中滴加硝酸酸化的AgNO3溶液,若产生白色沉淀,则证明原溶液中含有Cl-
【解析】
(1)据物质导电的原因分析,只要含有自由移动的离子或自由电子即可;
(2)在水溶液里或熔融状态下都不能导电的化合物是非电解质,包括非金属氧化物、一些氢化物和大部分有机物;
(3)根据物质导电的原因分析,只要水溶液含有自由移动的离子即可;
(4) 碳酸氢钠与盐酸反应生成氯化钠、二氧化碳和水;
(5)Ⅰ向溶液中加入过量的BaCl2溶液,有白色沉淀产生,说明原溶液中没有Ba2+;Ⅲ 将Ⅰ中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生可知一定含有SO42-和CO32-;由于加入BaCl2溶液引入了Cl-,所以不能由实验Ⅱ确定原溶液中是否含Cl-;而CO32-与H+不能大量共存,所以肯定不含有(大量)H+;这样,在3种阳离子中只剩下Na+了,则必然含有Na+;据以上分析解答。
(1)③铁、⑧石墨中均有自由电子,所以能导电,⑥熔融的K2SO4有自由移动的离子,所以能导电;①碳酸氢钠晶体、②液态氯化氢、④蔗糖、⑤酒精、⑦干冰中没有自由移动的离子或自由电子,所以不能导电;因此,本题正确答案是:③⑥⑧。
(2)在水溶液里和熔融状态下都不能导电的化合物是非电解质,④蔗糖、⑤酒精、⑦干冰属于非电解质;因此,本题正确答案是: ④⑤⑦。
(3)①碳酸氢钠晶体、②液态氯化氢、⑥熔融的K2SO4、⑦干冰等上述物质溶于水后,溶液中存在自由移动的离子而导电;因此,本题正确答案是: ①②⑥⑦。
(4)①碳酸氢钠溶液与盐酸反应生成二氧化碳和水,离子方程式为:H++HCO3-== H2O+ CO2↑;综上所述所,本题答案是:H++HCO3-== H2O+ CO2↑。
(5)Ⅰ向溶液中加入过量的BaCl2溶液,有白色沉淀产生,说明原溶液中没有Ba2+;Ⅲ 将Ⅰ中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生可知一定含有SO42-和CO32-;由于加入BaCl2溶液引入了Cl-,所以不能由实验Ⅱ确定原溶液中是否含Cl-;而CO32-与H+不能大量共存,所以肯定不含有(大量)H+;这样,在3种阳离子中只剩下Na+了,则必然含有Na+;
结合以上分析可知:原溶液中一定含有SO42-、CO32-、Na+;一定没有H+、Ba2+;可能含有Cl-;检验氯离子常用硝酸和硝酸银溶液,具体操作如下:取少量溶液于试管中,向溶液中滴加硝酸酸化的AgNO3溶液,若产生白色沉淀,则证明原溶液中含有Cl-;综上所述,本题答案是:取少量溶液于试管中,向溶液中滴加硝酸酸化的AgNO3溶液,若产生白色沉淀,则证明原溶液中含有Cl-。

【题目】某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚(CH3OCH3)等清洁燃料。由天然气获得该合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图所示,则在10 min时,改变的外界条件可能是__________________________。
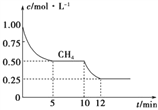
(2)反应③中ΔH3=_____________。800 ℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系式是_________(填代号)。
a.v正>v逆 b.v正<逆 c.v正=v逆 d.无法判断
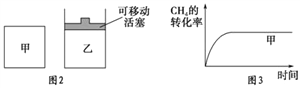
(3)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。___________
(4)某合成气的主要成分中的一氧化碳,在一定条件下也可用NaOH溶液与CO反应生成甲酸钠(HCOONa),进一步反应生成甲酸来消除CO污染。常温下将a mol的CO通入2 L b mol·L-1NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液(假设溶液体积不变),测得溶液中c(Na+)=c(HCOO-),则该混合溶液中甲酸的电离平衡常数Ka=_________(用含a和b的代数式表示)。
【题目】大量排放氮的氧化物会产生酸雨、光化学烟雾等环境问题。工业上处理氮的氧化物途径有多种:
Ⅰ.碱吸祛。利用纯碱溶液吸收NO、NO2,发生的反应有:
2NO2+Na2CO3=NaNO3+NaNO2+CO2,NO+NO2+Na2CO3=2NaNO2+CO2
用一定量纯碱溶被吸收NO、NO2恰好完全反应得到吸收溶液。
(1)向吸收溶液中滴加酸性高锰酸钾溶液,溶液褪色,氧化产物为NO3-,写出离子方程式__________
Ⅱ.天然气还原法。
CH4催化还原NO、NO2的热化学方程式如下:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574k]/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ/mol
(2)4NO(g)=N2(g)+2NO2(g)ΔH=_________
(3)上述物质NaNO2、NO、CO2中含有共同的化学键的类型是_______
Ⅲ.活性炭还原法。
在VL恒容密闭容器中加入足量的活性炭和一定量NO,恒温(T1)条件下发生反应生成Q、P(均为无污染物质)。测得物质的量与时间关系如表所示:
n/mol t/min | NO | Q | P |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
(4)在T1温度下,NO的平衡转化率为_______;平衡常数K为_________(用分数表示)。
(5)30min后,将温度升高至T2达到平衡时,容器中NO、Q、P的浓度之比为3:1:1,则该反应的正反应ΔH_____0(填“>”“<”或“=”)。在T2温度达到平衡之后,再向容器中充入少量NO,则NO的平衡转化率将_____________“变大”“不变”“变小”)。