题目内容
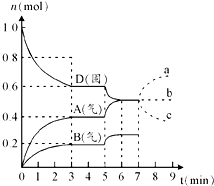 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是( )
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是( )| A、从反应开始到第一次达到平衡时,A物质的平均反应速率为0.667mol/(L?min) |
| B、该反应的化学方程式为2D(s)?2A(g)+B(g)该反应的平衡常数表达式为K=c(A)2?c(B) |
| C、已知反应的△H>0,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度 |
| D、若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线 |
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:A、根据V=
进行计算;
B、根据各物质的增减判断反应物、生成物,根据同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比判断;化学平衡常数等于平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
C、根据图可知,第5分钟时D的物质的量减少,A、B的物质的量增大,平衡正向移动,由于该反应为吸热反应,所以可推知此时变化的原因可能是升高温度;
D、增加固体的物质的量,浓度不变,平衡不移动.
| △c |
| △t |
B、根据各物质的增减判断反应物、生成物,根据同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比判断;化学平衡常数等于平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
C、根据图可知,第5分钟时D的物质的量减少,A、B的物质的量增大,平衡正向移动,由于该反应为吸热反应,所以可推知此时变化的原因可能是升高温度;
D、增加固体的物质的量,浓度不变,平衡不移动.
解答:
解:A、从反应开始到第一次达到平衡时,A物质的平均反应速率为
=0.0667mol/L?min,故A错误;
B、根据图象知,随着反应的进行,D的物质的量减少,A、B的物质的量增加,所以D是反应物,A、B是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0-3min时,△D=0.4mol,△A=0.4mol,△B=0.2mol,△D:△A:△B=0.4mol:0.4mol:0.2mol=4:4:2,方程式为:2D(s) ?2A(g)+B(g); 因D为固体,所以化学平衡常数K=C2(A)×C(B),故B正确;
?2A(g)+B(g); 因D为固体,所以化学平衡常数K=C2(A)×C(B),故B正确;
C、根据图可知,第5分钟时D的物质的量减少,A、B的物质的量增大,平衡正向移动,由于该反应为吸热反应,所以可推知此时变化的原因可能是升高温度,故C正确;
D、D为固体,增加D的物质的量,浓度不变,平衡不移动,A的物质的量变化情况符合b曲线,故D正确;
故选A.
| ||
| 3min |
B、根据图象知,随着反应的进行,D的物质的量减少,A、B的物质的量增加,所以D是反应物,A、B是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0-3min时,△D=0.4mol,△A=0.4mol,△B=0.2mol,△D:△A:△B=0.4mol:0.4mol:0.2mol=4:4:2,方程式为:2D(s)
 ?2A(g)+B(g); 因D为固体,所以化学平衡常数K=C2(A)×C(B),故B正确;
?2A(g)+B(g); 因D为固体,所以化学平衡常数K=C2(A)×C(B),故B正确;C、根据图可知,第5分钟时D的物质的量减少,A、B的物质的量增大,平衡正向移动,由于该反应为吸热反应,所以可推知此时变化的原因可能是升高温度,故C正确;
D、D为固体,增加D的物质的量,浓度不变,平衡不移动,A的物质的量变化情况符合b曲线,故D正确;
故选A.
点评:本题考查了化学平衡、平衡常数的影响因素,平衡计算分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| B、在水溶液里,乙酸分子中的-CH3可以电离出H+ |
| C、溴乙烷、乙醇在相同条件下均可发生消去反应生成乙烯 |
| D、苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
在2L的密闭容器中,发生如下反应:3A+B?2C (A、B、C均为气体),若最初加入的A、B都是4mol,10s内用A表示的平均反应速率为0.12mol/(L?s),则10s后容器中的B的物质的量是( )
| A、2.8 mol |
| B、1.6 mol |
| C、3.2 mol |
| D、3.6 mol |
某气态烃1mol与2mol HCl发生加成反应,所得的加成产物每摩又能与8mol氯气反应,最后得到一种只含碳、氯元素的化合物,则气态烃为( )
| A、丙炔 | B、1,3-丁二烯 |
| C、1-丁烯 | D、丙烯 |
各组性质比较的表示中,正确的是( )
| A、还原性:HF<HCl<HBr<HI |
| B、稳定性:NH3<SiH4 |
| C、氧化性:F2<Cl2<Br2<I2 |
| D、熔、沸点:H2O<H2S |
钡离子具有毒性,但在肠胃放射性检查中,却常服用“钡餐”.为减少微量溶解的钡离子对人体的伤害,“钡餐”中含有一种保护成分,其可能为( )
| A、碳酸钡 | B、硫酸钠 |
| C、稀硫酸 | D、碳酸钠 |
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的主要成分是( )
| A、MgCl2 |
| B、AlCl3 |
| C、NaAlO2和NaCl |
| D、Mg(OH)2和Al(OH)3 |
下列有关物质的用途(括号内为用途)错误的是( )
| A、硅(半导体材料) |
| B、二氧化硅(制光导纤维材料) |
| C、水玻璃(黏合剂) |
| D、硅酸(作耐火材料) |