题目内容
在2L的密闭容器中,发生如下反应:3A+B?2C (A、B、C均为气体),若最初加入的A、B都是4mol,10s内用A表示的平均反应速率为0.12mol/(L?s),则10s后容器中的B的物质的量是( )
| A、2.8 mol |
| B、1.6 mol |
| C、3.2 mol |
| D、3.6 mol |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:根据A的反应速率计算出A的物质的量的变化量△n(A),再根据方程式计算出B的物质的量的变化量△n(B),10s后容器中B的物质的量为B的起始物质的量减去B的物质的量的变化量△n(B).
解答:
解:10s内A的物质的量的变化量△n(A)=0.12mol/(L?s)×10s×2L=2.4mol,根据方程式3A+B?2C,可知△n(B)=
△n(A)=
×2.4mol=0.8mol,故10s后容器中B的物质的量为4mol-0.8mol=3.2mol,
故选C.
| 1 |
| 3 |
| 1 |
| 3 |
故选C.
点评:本题考查化学反应速率的有关计算,比较基础,注意变化的物质的量之比等于化学计量数之比.

练习册系列答案
相关题目
同周期主族元素,随原子序数递增,下列说法中错误的是( )
| A、最外层电子数逐渐增多 |
| B、原子半径逐渐减小 |
| C、元素最高正化合价由+1递增到+7 |
| D、金属性逐渐减弱,非金属性逐渐增强 |
用括号内的试剂和方法,除去下列物质中的少量杂质,不正确的是( )
| A、乙烷中混有乙烯(溴水、洗气) |
| B、苯中混有苯酚(溴水、过滤) |
| C、乙酸乙酯中混有乙酸(饱和碳酸钠溶液、分液) |
| D、乙酸钠中混有碳酸钠(乙酸、蒸发) |
 一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )| A、10min时,反应达到平衡 |
| B、达到平衡时N2O5的转化率为60% |
| C、0~20min内平均反应速率v(N2O5)=0.04mol?L-1?min-1 |
| D、曲线a表示NO2的物质的量随反应时间的变化 |
某饱和烃的一溴代物有三种同分异构体,其分子的结构式为( )
| A、CH3-CH2-CH2-CH3 |
B、 |
C、 |
D、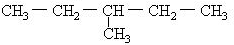 |
下列有机物不能通过乙烯的加成反应制取的是( )
| A、CH3CH2Cl |
| B、CH3-CHCl2 |
| C、CH3-CH2OH |
| D、CH3-COOH |
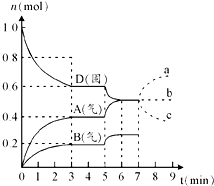 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是( )
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是( )| A、从反应开始到第一次达到平衡时,A物质的平均反应速率为0.667mol/(L?min) |
| B、该反应的化学方程式为2D(s)?2A(g)+B(g)该反应的平衡常数表达式为K=c(A)2?c(B) |
| C、已知反应的△H>0,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度 |
| D、若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线 |
绿色电源“二甲醚-氧气燃料电池”的工作原理如图,所示下列说法正确的是( )
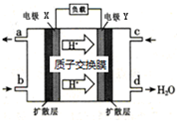

| A、氧气应从c处通入,电极Y上发生的反应为O2+4e-+2H2O═4OH- |
| B、电池在放电过程中,电极X周围溶液的pH增大 |
| C、二甲醚应从b处加入,电极X上发生的反应为(CH3)2O-12e-+3H2O=2CO2+12H+ |
| D、当该电池向外电路提供2mol电子时消耗O2约为22.4L |