题目内容
将2.5mol A和1.25mol B通入容积为1L的真空密闭容器中,经5s达到平衡状态.3A(g)+B(g)?pC(g)+2D(g),生成0.5molD,又知C的平均反应速率是0.1mol/(L?s),则下列说法中正确的是( )
①A的转化率为20% ②B的转化率为25% ③A的平均反应速率为0.1mol/(L?s) ④方程式中p=2 ⑤B的平均反应速率为0.05mol/(L?s)
①A的转化率为20% ②B的转化率为25% ③A的平均反应速率为0.1mol/(L?s) ④方程式中p=2 ⑤B的平均反应速率为0.05mol/(L?s)
| A、①② | B、②③ | C、③④ | D、④⑤ |
考点:化学平衡的计算
专题:化学平衡专题
分析:根据计量数之比等于速率之比,确定p的值,利用三段式计算平衡时各组分的平衡浓度,进而计算出转化率和反应速率;
解答:
解:5s后达到平衡生成0.5mol D,则v(D)=
=0.10mol?L-1?min-1,速率之比等于化学计量数之比,故p:2=0.1:0.1,解得p=2,故④正确;
3A(气)+B(气) ?2C(气)+2D(气),
?2C(气)+2D(气),
开始(mol/L):2.5 1.25 0 0
变化(mol/L):0.75 0.25 0.5 0.5
平衡(mol/L):1.75 1 0.5 0.5
A的转化率为
×100%=30%,故①错误;
B的转化率为
×100%=20%,故②错误;
A的平均反应速率为
=0.25mol/(L?s),故③错误;
B的平均反应速率为
=0.05mol/(L?s),故⑤正确;
故选D.
| ||
| 5s |
3A(气)+B(气)
 ?2C(气)+2D(气),
?2C(气)+2D(气),开始(mol/L):2.5 1.25 0 0
变化(mol/L):0.75 0.25 0.5 0.5
平衡(mol/L):1.75 1 0.5 0.5
A的转化率为
| 0.75 |
| 2.5 |
B的转化率为
| 0.25 |
| 1.25 |
A的平均反应速率为
| 0.75mol/L |
| 5s |
B的平均反应速率为
| 0.25 mol/L |
| 5s |
故选D.
点评:本题考查化学平衡的计算、化学反应速率、转化率的计算,题目难度中等,注意掌握三段式法解题法.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
用括号内的试剂和方法,除去下列物质中的少量杂质,不正确的是( )
| A、乙烷中混有乙烯(溴水、洗气) |
| B、苯中混有苯酚(溴水、过滤) |
| C、乙酸乙酯中混有乙酸(饱和碳酸钠溶液、分液) |
| D、乙酸钠中混有碳酸钠(乙酸、蒸发) |
某饱和烃的一溴代物有三种同分异构体,其分子的结构式为( )
| A、CH3-CH2-CH2-CH3 |
B、 |
C、 |
D、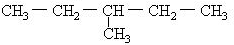 |
下列有机物不能通过乙烯的加成反应制取的是( )
| A、CH3CH2Cl |
| B、CH3-CHCl2 |
| C、CH3-CH2OH |
| D、CH3-COOH |
下列说法中不正确的是( )
| A、蒸馏是分离提纯相互互溶的液态有机物的常用方法 |
| B、石油分馏可获得乙烯、丙烯和丁二烯 |
| C、通过煤的直接或间接液化,可以获得燃料油及多种化工原料 |
| D、重结晶法提纯苯甲酸时,杂质的溶解度很小或很大均易于除去 |
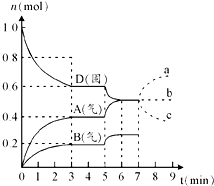 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是( )
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是( )| A、从反应开始到第一次达到平衡时,A物质的平均反应速率为0.667mol/(L?min) |
| B、该反应的化学方程式为2D(s)?2A(g)+B(g)该反应的平衡常数表达式为K=c(A)2?c(B) |
| C、已知反应的△H>0,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度 |
| D、若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线 |
科学家预言超级原子的发现将会重建周期表.美国科学家曾在《Science》上发表论文,宣布发现了Al的超级原子Al13和Al14.①Al13、Al14的性质很像现行周期表中的某主族元素,已知这类超级原子具有40个价电子时最稳定.②在质谱仪上检测到稳定的Al13-.下列说法不正确的是( )
| A、Al13与卤素原子性质相似,能形成稳定的Al13- |
| B、Al14与ⅡA族元素性质相似,容易失去2个电子形成稳定的Al142+ |
| C、Al14与HI反应的化学方程式为Al14+2HI═Al14I2+H2↑ |
| D、超级原子Al13中铝原子间是通过离子键结合的 |
碲的某化合物就是常用的VCD光盘记录材料之一,碲位于钾的下一周期,与氧元素同一主族,对碲及其化合物的以下认识中不正确的是( )
| A、单质碲在常温下是固体 |
| B、H2TeO4的酸性比H2SO4的酸性弱 |
| C、H2Te不如HI稳定 |
| D、Te元素位于第六周期ⅥA族 |