��Ŀ����
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ١�����Ԫ�أ���Ԫ�ط��Ż�ѧʽ��ջش��������⣺

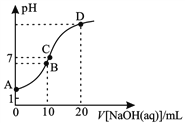
��1���ڢۡ�����Ԫ�أ�ԭ�Ӱ뾶������_____________�������ӵĽṹʾ��ͼ��__________________��
��2�����еĢ١�����Ԫ�أ��ǽ�������ǿ����_______����ѧ�������ȶ�����________����������ǿ����__________������������ˮ�����������ǿ���ǣ�д��ˮ����Ļ�ѧʽ��______________��
��3���ߵ��⻯���ˮ��Һ��ٵ��⻯���ˮ��Һ��Ӧ�����ӷ���ʽΪ___________________________��
��4����һ����ѧ��Ӧ˵���߱Ȣ�ĵ��ʻ�ѧ���ʻ��ã�д����Ӧ�Ļ�ѧ����ʽ��_____________________��
���𰸡� Na ![]() F Ar K HClO4 H����NH3��H2O=== NH4+ + H2O 2NaBr��Cl2��2NaCl��Br2
F Ar K HClO4 H����NH3��H2O=== NH4+ + H2O 2NaBr��Cl2��2NaCl��Br2
������������:���⿼�����Ԫ�����ڱ���Ԫ�������ɣ��dz������ͣ�����Ԫ�������ڱ���λ�ý��з������ɡ�
����Ԫ�������ڱ��е�λ�÷�������Ϊ��Ԫ�أ���Ϊ��Ԫ�أ���Ϊ��Ԫ�أ���ΪþԪ�أ���Ϊ��Ԫ�أ���Ϊ��Ԫ�أ���Ϊ��Ԫ�أ���Ϊ�Ԫ�أ���Ϊ��Ԫ�أ���Ϊ��Ԫ�ء� (1). ����ͬ����Ԫ���д�����ԭ�Ӱ뾶���μ�С�������ڢۡ�����Ԫ�أ���ԭ�Ӱ뾶��������ӵĽṹʾ��ͼΪ![]() ��(��) ����ͬ����Ԫ���д����ҷǽ�������ǿ�������Լ�����ͬ����Ԫ�ش������ϣ��ǽ�������ǿ�������Լ��������������еĢ١�����Ԫ�أ��ǽ�������ǿ��F����ѧ�������ȶ�����Ar����������ǿ��ΪK���ǽ�����Խǿ��������������Ӧ��ˮ���������Խǿ��������ǿ��ΪHClO4��(��)�ȵ��⻯���ˮ��ҺΪ���ᣬ�����⻯���ˮ��ҺΪ��ˮ�����߷�Ӧ�����Ȼ�狀�ˮ�����ӷ���ʽΪ��H����NH3��H2O=== NH4+ + H2O��(��) �����ķǽ����Ա���ǿ�������õ��ʵ��û���Ӧ���������������廯�Ʒ�Ӧ�����Ȼ��ƺ��壬����ʽΪ��2NaBr��Cl2��2NaCl��Br2��
��(��) ����ͬ����Ԫ���д����ҷǽ�������ǿ�������Լ�����ͬ����Ԫ�ش������ϣ��ǽ�������ǿ�������Լ��������������еĢ١�����Ԫ�أ��ǽ�������ǿ��F����ѧ�������ȶ�����Ar����������ǿ��ΪK���ǽ�����Խǿ��������������Ӧ��ˮ���������Խǿ��������ǿ��ΪHClO4��(��)�ȵ��⻯���ˮ��ҺΪ���ᣬ�����⻯���ˮ��ҺΪ��ˮ�����߷�Ӧ�����Ȼ�狀�ˮ�����ӷ���ʽΪ��H����NH3��H2O=== NH4+ + H2O��(��) �����ķǽ����Ա���ǿ�������õ��ʵ��û���Ӧ���������������廯�Ʒ�Ӧ�����Ȼ��ƺ��壬����ʽΪ��2NaBr��Cl2��2NaCl��Br2��

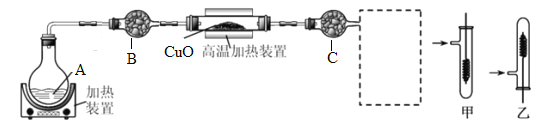
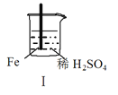
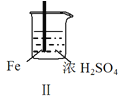
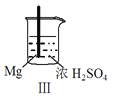
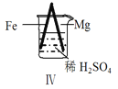
����Ŀ�� Fe��Mg��H2SO4��Ӧ��ʵ�����£�
ʵ�� |
|
|
|
|
���� | Fe�������������ɫ���� | Fe����������ݺ�Ѹ��ֹͣ | Mg����Ѹ�ٲ����������� | Fe�����д������ݣ�Mg�������������� |
��������ʵ��˵�������������� ��
A��I�в��������ԭ���ǣ�Fe + 2H��=Fe2��+ H2��
B��ȡ�����е���������CuSO4��Һ������������ɫ����
C����������˵��Mg��ŨH2SO4��û���ۻ�
D����������˵��Mg�Ľ����Ա�Feǿ