题目内容
【题目】某化学小组试利用废铝屑(含杂质铁)制备硫酸铝晶体,并对硫酸铝晶体进行热重分析,其主要实验流程如图1: 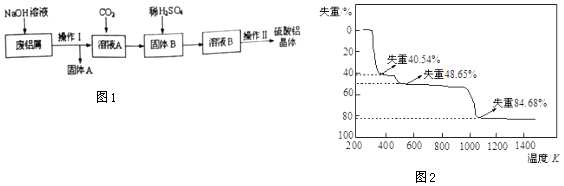
(1)向溶液A中通入过量的CO2 , 发生反应的离子方程式为 .
(2)操作II所包含的实验操作的名称依次为、冷却结晶、、洗涤、干燥.
(3)若开始时称取的废铝屑的质跫为5.00g,得到固体A的质量为0.95g,硫酸铝晶体的质量为49.95g(假设每一步的转化率均为100%),则所得硫酸铝晶体的化学式为 .
(4)取以上制得的硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:第一阶段失重40.54%,第二阶段失重48.65%,第三阶段失重84.68%,以后不再失重.其热分解的曲线如图2所示. 已知:失重%= ![]() ×100%
×100%
①失重第一阶段反应的化学方程式为 .
②失重第三阶段残留固体的化学式为 .
【答案】
(1)2Al+2NaOH+2H2O═2NaAlO2+3H2↑
(2)蒸发浓缩;过滤
(3)Al2(SO4)3·18H2O
(4)Al2(SO4)3.18H2O ![]() Al2(SO4)3.3H2O+15H2O; Al2(SO4)3
Al2(SO4)3.3H2O+15H2O; Al2(SO4)3![]() Al2O3+3SO3↑
Al2O3+3SO3↑
【解析】解:(1)Al和氢氧化钠溶液生成可溶性的偏铝酸钠与氢气,镁不反应,反应方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;(2)从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作;
故答案为:蒸发浓缩;过滤;(3)Al的质量为5g﹣0.95g=4.05g,其物质的量为4.05g÷27g/mol=0.15mol,设硫酸铝晶体化学式为:Al2(SO4)3·nH2O,根据Al元素守恒,硫酸铝晶体的物质的量为0.15mol÷2=0.075mol,故硫酸铝晶体的相对分子质量为49.95÷0.075=666,则54+96×3+18n=666,解得n=18,故该硫酸铝晶体的化学式为:Al2(SO4)3·18H2O;
故答案为:Al2(SO4)3.18H2O;(4)晶体中结晶水的含量为 ![]() =48.65%,故第二阶段完全失去结晶水,得到物质为Al2(SO4)3,第一阶段失去部分结晶水,失去结晶水数目为
=48.65%,故第二阶段完全失去结晶水,得到物质为Al2(SO4)3,第一阶段失去部分结晶水,失去结晶水数目为 ![]() =15,故第一阶段得到的物质为Al2(SO4)3·3H2O,反应方程式为:Al2(SO4)3·18H2O
=15,故第一阶段得到的物质为Al2(SO4)3·3H2O,反应方程式为:Al2(SO4)3·18H2O ![]() Al2(SO4)3·3H2O+15H2O;
Al2(SO4)3·3H2O+15H2O;
第三阶段剩余物质的相对分子质量为666×(1﹣84.68%)=102,应是Al2O3,故硫酸铝反应生成氧化铝与三氧化硫,反应方程式为:Al2(SO4)3 ![]() Al2O3+3SO3↑;
Al2O3+3SO3↑;
故答案为:Al2(SO4)3.18H2O ![]() Al2(SO4)3.3H2O+15H2O;Al2(SO4)3
Al2(SO4)3.3H2O+15H2O;Al2(SO4)3 ![]() Al2O3+3SO3↑.
Al2O3+3SO3↑.
向废铝屑(含杂质铁)中加入足量氢氧化钠溶液,发生反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,铁不反应,固体A为Fe,采用过滤的方法进行分离,溶液A为NaAlO2溶液,向其中通入二氧化碳,发生反应:NaAlO2+CO2+2H2O═Al(OH)3↓+NaHCO3,再通过过滤进行分离,固体B为氢氧化铝,氢氧化铝与硫酸反应得到硫酸铝溶液,再经过蒸发浓缩、冷却结晶、洗涤、干燥得到硫酸铝晶体;(1)Al和氢氧化钠溶液生成可溶性的偏铝酸钠;(2)从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作;(3)Al的质量为5g﹣0.95g=4.05g,设硫酸铝晶体化学式为:Al2(SO4)3·nH2O,根据Al元素守恒计算硫酸铝晶体的物质的量,再计算硫酸铝晶体的相对分子质量,进而计算n的值,确定化学式;(4)根据(3)中计算可知,晶体中结晶水的质量分数,低温加热,首先失去结晶水,高温下,最终硫酸铝分解,根据失重计算判断各阶段分解产物,再书写化学方程式.