题目内容
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。

(1)a极是 极,b极是 极,电极
反应式分别为 , 。
(2)飞船上宇航员的生活用水由燃料电池提供。已知这种电池发1度电时能生成350g水,试计算能量转化率。
 [2H2(g)+O2(g)
2H2O(l)+572kJ]
[2H2(g)+O2(g)
2H2O(l)+572kJ]
(3)这种电池的输出电压为1.2V。要使标有1.2V,1.5W的小灯泡连续发光0.5h,应消耗标准状况下的H2多少升?
(4)氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料,往往是某些碳氢化合物,如甲烷(天然气)、汽油等。请写出将图中H2换成CH4时所构成的甲烷燃料电池中a极的电极反应式: 。此时电池内总的反应方程式为 。
(1)负 正 2H2+4OH—-4e=4H2O O2+2H2O+4e—=4OH—
(2)64.7%
(3)0.327L
(4)CH4+10OH—-8e—=CO32—+7H2O CH4+2O2+2OH—=CO32—+3H2O
【解析】
试题分析:(1)原电池中负失去电子,发生氧化反应。正极得到电子,发生还原反应。所以氢气在负极通入,氧气在正极通入,因此a是氢氧燃料电池负极,b是正极。由于电解质溶液是氢氧化钾溶液,所以负极电极反应式是2H2+4OH—-4e=4H2O,正极电极反应式是O2+2H2O+4e—=4OH—。
(2)350g水的物质的量是350g÷18g/mol=19.4mol,每生成2mol的水放出的热量是572kJ,所以理论上生成350g水应该放出的热量是(19.4mol÷2)×572kJ/mol=5561kJ。而一度电能量是3.6×106J,所以能量转化率就是3.6×106J÷5561000×100%=64.7%。
(3)W=Pt=1.5 J/s×1800 s=2.7kJ
所以消耗标准状况下H2的体积为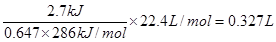
(4)甲烷的燃烧产物是CO2和水,在碱性溶液中CO2和氢氧化钾反应生成碳酸钾,所以负极电极反应式是CH4+10OH—-8e—=CO32—+7H2O,总的反应式是CH4+2O2+2OH—=CO32—+3H2O。
考点:考查电化学原理的综合应用
点评:该题是高考中的常见题型,为中等难度的试题。试题基础性强,难易适中,有利于考查学生答题能力,也有利于培养学生的逻辑思维能力,特别是思维的严谨性,提高学生的学习效率。


 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电.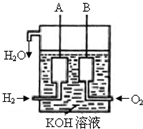 已知在25°C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
已知在25°C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题: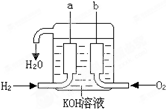 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,被称为21世纪的明星电池,其构造如图所示:两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,被称为21世纪的明星电池,其构造如图所示:两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电. 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.