题目内容
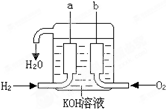 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,被称为21世纪的明星电池,其构造如图所示:两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,被称为21世纪的明星电池,其构造如图所示:两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.(1)a是
负
负
极(填“正”或“负”),其pH值降低
降低
(填升高、降低或不变),b极的电极反应式O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
.(2)某些碳氢化合物也可作为燃料电池的燃料,如天然气(甲烷)等.若将图中H2换成CH4时,电池内总的反应方程式为:CH4+2O2+2OH-=CO32-+3H2O.请写出a极的电极反应式
CH4+10OH--8e-=CO32-+7H2O
CH4+10OH--8e-=CO32-+7H2O
.在电池工作期间,CO32-流向a
a
极(填a或b).分析:(1)氢氧燃料电池中,通入氢气的一极为电源的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极为原电池的正极,电极反应式为O2+4e-+2H2O=4OH-,原电池工作时,电子由负极经外电路流向正极,氢氧燃料电池的总反应为:2H2+O2=2H2O;
(2)依据燃料电池反应的原理分析,燃料被氧化做原电池的负极,氧气得到电子做原电池的正极反应还原反应;
(2)依据燃料电池反应的原理分析,燃料被氧化做原电池的负极,氧气得到电子做原电池的正极反应还原反应;
解答:解:(1)氢氧燃料电池中,通入氢气的一极a为电源的负极,通入氧气的一极b为原电池的正极,由于电解质溶液呈碱性,则负极电极反应式为:2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O),电极附近溶液PH降低;正极电极反应式为:O2+4e-+2H2O=4OH-,故答案为:负;降低;O2+4e-+2H2O=4OH-;
(2)电池内总的反应方程式为:CH4+2O2+2OH-=CO32-+3H2O,依据元素化合价变化得到,甲烷失去电子发生氧化反应,氧气得到电子发生还原反应,a电极是失电子发生氧化反应做负极,正极电极反应为:O2+4e-+2H2O=4OH-;总电池反应减去正极电极反应乘以2,得到负极电极反应为:CH4+10OH--8e-=CO32-+7H2O;原电池中阴离子移向负极,碳酸根离子移向负极a;
故答案为:CH4+10OH--8e-=CO32-+7H2O;a;
(2)电池内总的反应方程式为:CH4+2O2+2OH-=CO32-+3H2O,依据元素化合价变化得到,甲烷失去电子发生氧化反应,氧气得到电子发生还原反应,a电极是失电子发生氧化反应做负极,正极电极反应为:O2+4e-+2H2O=4OH-;总电池反应减去正极电极反应乘以2,得到负极电极反应为:CH4+10OH--8e-=CO32-+7H2O;原电池中阴离子移向负极,碳酸根离子移向负极a;
故答案为:CH4+10OH--8e-=CO32-+7H2O;a;
点评:本题考查了原电池工作原理的应用,电极判断,电极反应是解题关键,题目难度中等.

练习册系列答案
相关题目

 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电.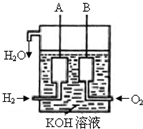 已知在25°C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
已知在25°C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题: 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.